
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为
Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:_______________________________________________,
________________________________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是
________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO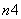 +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO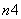 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2 C.H2S D.O2
答案 (1)NaClO+2FeSO4+H2SO4===NaCl+Fe2(SO4)3+H2O
NaClO3+6FeSO4+3H2SO4===NaCl+3Fe2(SO4)3+3H2O
相同质量NaClO3比NaClO能氧化更多的Fe2+
(2)2 5-n 2n 2 5-n 3+n
(3)2
(4)BC
解析 (1)根据题干信息,A(或B)为FeSO4,B(或A)为H2SO4,根据电子守恒配平。因为NaCl3O中氯元素的化合价为+5价,NaClO中氯元素的化合价为+1价,相同质量的两种物质,NaClO3氧化更多的Fe2+。
(2)
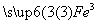 (OH)3+
(OH)3+
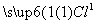 O-+
O-+ OH-―→
OH-―→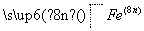 O
O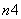 +
+
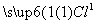 -+
-+ H2O,Fe的化合价升高5-n,氯的化合价降低2,根据电子守恒、电荷守恒、原子守恒,系数依次为:2,5-n,2n,2,5-n,3+n。
H2O,Fe的化合价升高5-n,氯的化合价降低2,根据电子守恒、电荷守恒、原子守恒,系数依次为:2,5-n,2n,2,5-n,3+n。
(3)电子转移数为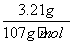 ×(5-n)×NA=5.418×1022,解得n=2。
×(5-n)×NA=5.418×1022,解得n=2。
(4)FeO 具有强氧化性,能氧化SO2、H2S等还原性物质。
具有强氧化性,能氧化SO2、H2S等还原性物质。


科目:高中化学 来源: 题型:
下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | |||||||
| b | c | d | |||||
| e | f | g |
(1)f元素在周期表中的位置是 ;g元素原子结构示意图为 ;
(2)e在空气中燃烧的产物所含化学键的类型为 、 ;
(3)化合物ca3的电子式为 ,ca3的催化氧化反应的化学方程式为 ;
(4)用电子式表示e与g元素形成化合物的过程 ;a与d组成18电子的分子化学式为 。
(5)a、c、d中的两种元素可组成具有10个电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式 。
(6)由a、b、c、d四种元素中的三种元素组成的某种化合物的浓溶液,可与其中的第四种元素的单质发生反应,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2)____P4+____KOH+____H2O===____K3PO4+____PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
(2013·北京理综,27)用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_________________________________________
________________________________________________________________________。
(2)将MnO 氧化Fe2+的离子方程式补充完整:
氧化Fe2+的离子方程式补充完整:
 MnO
MnO +
+ Fe2++
Fe2++ ________===
________=== Mn2++
Mn2++ Fe3++
Fe3++ ________。
________。
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的___________________________________________。
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ________________________________________________________________________。
②Ⅳ中加入MnSO4的目的是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )
A.(b-2 a) mol B.
a) mol B.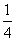 b mol
b mol
C.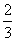 a mol D.2a mol
a mol D.2a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=+890 kJ/mol
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
D.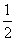 CH4(g)+O2(g)===
CH4(g)+O2(g)===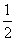 CO2(g)+H2O(l) ΔH=-890 kJ/mol
CO2(g)+H2O(l) ΔH=-890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
上海人张霞昌在芬兰发明了“纸电池”,这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,纸内的离子“流过”水和氧化锌组成的电解质溶液,电池总反应式为:
Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是
A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为MnO2+H2O+e-===MnOOH+OH-
D.当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:

己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
B.溶液颜色保持不变,说明上述可逆反应达到达平衡状态
C.常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)= n(B)=________mol;
B的平均反应速率v(B)=________mol/(L·min);(3)x的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com