
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:
n(A)= n(B)=________mol;
B的平均反应速率v(B)=________mol/(L·min);(3)x的值为________。
科目:高中化学 来源: 题型:
工业上从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使之成为
Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的。生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+被氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):
NaClO+A+B―→NaCl+C+H2O
NaClO3+A+B―→NaCl+C+H2O
(1)请完成以上化学方程式:_______________________________________________,
________________________________________________________________________。
实际生产中采用NaClO3来氧化Fe2+比较合算,其理由是
________________________________________________________________________。
(2)配平下列离子方程式,并回答问题。
 Fe(OH)3+
Fe(OH)3+ ClO-+
ClO-+ OH-===
OH-=== FeO
FeO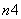 +
+ Cl-+
Cl-+ H2O
H2O
(3)已知有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=________。
(4)根据上述(2)(3)题推测FeO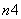 能与下列哪些物质反应________(只填序号)。
能与下列哪些物质反应________(只填序号)。
A.Cl2 B.SO2 C.H2S D.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常温下,pH=3的醋酸溶液(I)和 pH=11的氢氧化钠溶液(Ⅱ)的说法正确的是( )
A.I和Ⅱ的物质的量浓度均为0.001mol·L-1
B.将I稀释10倍,溶液中 c(CH3COOH)、 c(OHˉ)均减小
C.I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)> c(H+)> c(OH--)
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器内,可逆反应: ,达到平衡状态的标志是:
,达到平衡状态的标志是:
(1)单位时间内生成 的同时生成
的同时生成
(2)单位时间内生成 的同时生成
的同时生成
(3)用 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. (1)(3)(4) B. (2)(3)(5)
C. (1)(4)(5) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
| X | Y | ||
| Z | W | Q |
A.钠与Y可能形成Na2Y2化合物
B.Z的最高价含氧酸比X的最高价含氧酸的酸性强
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此推出ABn型分子是非极性分子的经验规律,正确的是( )
A.所有原子在同一平面内 B.分子中不含有氢原子
C.A的化合价的数值等于其最外层电子数 D.分子结构对称
查看答案和解析>>
科目:高中化学 来源: 题型:
Ni、K和F三种元素组成的一个化合物的晶胞如右图所示。该化合物的化学式及Ni的配位数为( )
A.K2NiF4;6 B.K4Ni2F8;8 C.K2NiF3;4 D.K2NiF6;6

查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com