
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是同族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.硅是良好的半导体材料,二氧化硅可用于制造光导纤维
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ①根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
该反应中氧化剂是______________,氧化产物是___________________。
②在方程式中用双线桥法表示出反应中的电子转移:_____________
8NH3+3Cl2=6NH4Cl+N2
Ⅱ.配平下列化学方程式或离子方程式,填写相关空白
①______KClO3+ ______HC1--_____KCl+ ______Cl2↑+ ______H2O
生成3 mol Cl2时转移电子的物质的量为______.
②______MnO4-+______SO2 +_____ _______=______Mn2++ ______SO42-+____ _____
氧化剂与氧化产物的物质的量之比是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是
A. 熔点:NaF>MgF2>AlF3B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaClD. 硬度:MgO>CaO>BaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4和MnO2都是重要的化学物质,在实验室可以作氧化剂和催化剂。某化学学习小组对两种物质的制备探究如下:
Ⅰ.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2的实验,其工艺流程如下:
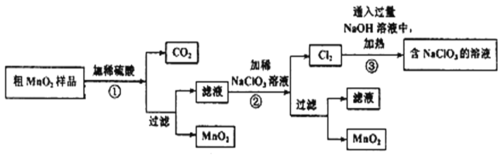
请回答下列问题:
(1)第②步操作中,NaClO3氧化MnSO4的离子方程式为______________
(2)第③步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的________(填序号)。
a.NaCl b.NaClO c.NaOH d.NaClO4
(3)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤。洗涤沉淀所用的玻璃仪器有______________。
(4)NaClO3和MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等量的氯气消耗NaClO3与MnO2的物质的量之比为__________。
Ⅱ.KMnO4的制备:
(5)实验室由二氧化锰制备高锰酸钾可分两步进行:
第一步:MnO2与KOH共熔并通入氧气:2MnO2+4KOH+O2=2K2MnO4+2H2O;
第二步:通入CO2,可使K2MnO4发生歧化反应生成KMnO4和MnO2。
第二步完成反应时,转化为KMnO4的K2MnO4占其全部的百分率约为________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下说法不正确的是( )
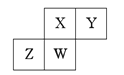
A.原子半径:Z>W>X>Y
B.最简单氢化物的熔沸点:X>Y>W>Z
C.最高价氧化物对应水化物的酸性:X>W>Z
D.化合物XY与ZY2中均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—空气电池是最常见也是最常用的一种镁燃料电池,电池构造如图所示,下列说法不正确的是
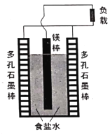
A.电池工作时![]() 、
、![]() 向两侧移动
向两侧移动
B.电池总反应是:![]()
C.该电池因存在![]() 副反应,导致性能降低
副反应,导致性能降低
D.多孔石墨电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取某些气体并进行一系列的性质探究。
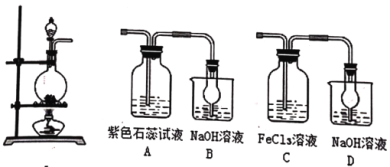
请回答:
(1)下列说法正确的是_____。
A.实验开始时,打开装置Ⅰ中分液漏斗的旋塞,液体能顺利滴下
B.将装置Ⅰ与Ⅱ连接,制取Cl2并检验其性质,其中B装置的作用为防倒吸
C.过量的铜与浓硫酸在装置Ⅰ中反应,反应后的溶液中溶质仅为硫酸铜
D.将装置Ⅰ和Ⅱ连接,制取SO2并检验其性质,A中的紫色石蕊试液只能变红
(2)将装置Ⅰ和装置Ⅲ连接,制取SO2并检验其性质。C中溶液颜色由棕黄色逐渐变浅绿色,反应的离子方程式为:_____,反应结束后C中的阴离子的检测方法为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
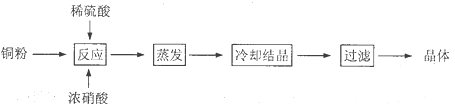
根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为___。
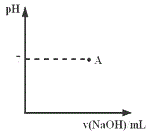
(2)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是___。
(3)请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。____
(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是___。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com