
【题目】Ⅰ①根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
该反应中氧化剂是______________,氧化产物是___________________。
②在方程式中用双线桥法表示出反应中的电子转移:_____________
8NH3+3Cl2=6NH4Cl+N2
Ⅱ.配平下列化学方程式或离子方程式,填写相关空白
①______KClO3+ ______HC1--_____KCl+ ______Cl2↑+ ______H2O
生成3 mol Cl2时转移电子的物质的量为______.
②______MnO4-+______SO2 +_____ _______=______Mn2++ ______SO42-+____ _____
氧化剂与氧化产物的物质的量之比是______
【答案】Cl2 N2 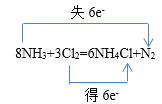 1 6 1 3 3 5mol 2 5 2 H2O 2 5 4 H+ 2:5
1 6 1 3 3 5mol 2 5 2 H2O 2 5 4 H+ 2:5
【解析】
Ⅰ由化学方程式可知,反应中N元素化合价由-3价变为0价,化合价升高被氧化,Cl元素化合价由0价变为-1价,化合价降低被还原,所以NH3是还原剂、Cl2是氧化剂;
Ⅱ依据化合价变化确定氧化剂和还原剂,由升降法和观察法配平可得。
Ⅰ①由化学方程式可知,反应中N元素化合价由-3价变为0价,化合价升高被氧化,Cl元素化合价由0价变为-1价,化合价降低被还原,所以NH3是还原剂、Cl2是氧化剂,故答案为:Cl2;N2;
②该反应中N元素化合价由-3价变为0价,Cl元素化合价由0价变为-1价,由化学方程式可知,反应中消耗3mol氯气转移6mol电子,用双线桥标出电子转移的方向和数目可为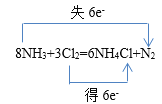 ,故答案为:
,故答案为: ;
;
Ⅱ①由题给未配平化学方程式可知,氯酸钾中氯元素化合价降低被还原,发生还原反应,氯化氢中氯元素部分化合价升高被氧化发生氧化反应,部分没有变化,则氯酸钾做氧化剂,氯化氢起还原剂和酸的作用,由升降法和观察法配平可得化学方程式为KClO3+6HC1=KCl+3Cl2↑+ 3H2O,由化学方程式可知,反应中生成3 mol Cl2时转移5mol电子,故答案为:1;6;1; 3;3;5mol;
②由题给未配平化学方程式可知,高锰酸根中锰元素化合价降低被还原发生还原反应,二氧化硫中硫元素化合价升高被氧化发生氧化反应,则高锰酸根做氧化剂,二氧化硫做还原剂,由升降法和观察法可得化学方程式为2MnO4-+5SO2 +2 H2O =2Mn2++ 5SO42-+4H+,由化学方程式可知,氧化剂MnO4-与氧化产物SO42-的物质的量之比是2:5,故答案为:2;5;2;H2O;2;5;4;H+;2:5。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为有机物,其中A 常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。已知醛基在氧气中易氧化成羧基,请回答下列问题:
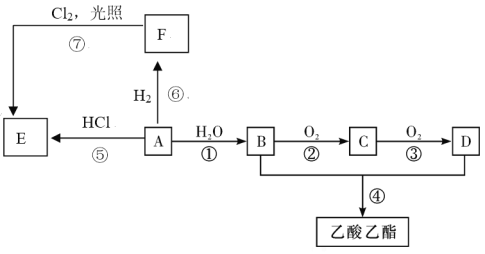
(1)A的分子式是_________,B中官能团的名称_____________。在反应①~④中,属于加成反应的是__________(填序号)。
(2)写出反应②的化学方程式:______________________________________________。
写出反应④的化学方程式:_________________________________________________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行A(g)+2B(s)![]() 2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
2C(s)+3D(s) ΔH>0的反应,下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 容器内气体平均相对分子质量不变时达到化学平衡状态
C. 温度不变,增大B的投入量,正反应速率增大
D. 温度不变,压缩容器体积重新达到平衡后,A的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验。实验装置如下图所示,A中盛有浓硫酸,插入一段下端已绕成螺旋状的铜丝,D为玻璃导管。
(1)装置A中发生反应的化学方程式为:_________________,该反应中浓硫酸的主要作用有_____________________。
(2)当B中盛有___________时,证明生成的气体产物具氧化性; 当B中盛有___________时,B中溶液颜色褪去,证明生成气体产物具有还原性。
(3)C为尾气处理装置,C中盛放的试剂为________________。
(4)有人建议在A之间B增加一个防倒吸的安全瓶,经该实验小组同学实验后发现,即使不加安全瓶熄灭酒精灯停止反应后,B中的液体也没有发生倒吸,请给出一个合理的解释_______。
(5)实验中,该小组同学取6.4g铜丝和12mL 18mol·L-1H2SO4溶液放在试管中共热充分反应直到反应停止,最后发现烧瓶中还有铜丝剩余;该小组同学根据所学的化学知识判断还会有一定量H2SO4的剩余,下列药品中能够用来验证反应停止后的试管中确有剩余的H2SO4的是________ 。
a.BaCl2溶液 b.Ba(NO3)2溶液 c.银粉 d.小苏打粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是()
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数之比为11:7
B.同体积、同密度的C2H4和CO两种气体的分子数一定相等
C.配制450 mL 0.1 mol﹒L-1NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L 0.45 mol﹒L-1NaCl溶液中Cl-的物质的量浓度比1 L 0.15 mol﹒L-1 AlCl3溶液大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(s)![]() xH(g)+2G(g),2min末该反应达到平衡,生成0.8molG,并测得H的浓度为0.2mol·L-1.下列判断正确的是( )
xH(g)+2G(g),2min末该反应达到平衡,生成0.8molG,并测得H的浓度为0.2mol·L-1.下列判断正确的是( )
A.x=2
B.2min内A的反应速率为0.3mol·(L·min) -1
C.维持其他条件不变,将该混合物转移到固定容积为1L的密闭容器中,再次平衡后H的浓度将大于0.4mol·L-1
D.维持其他条件不变,再向容器中加入足量物质A,最终H的浓度将达到0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,一定是同系物的是( )
A. C3H6和2—甲基—1—丁烯 B. 3,3—二甲基—1—丁炔和3—甲基—1—戊炔
C. ![]() 和
和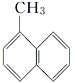 D. C4H10和C9H20
D. C4H10和C9H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是同族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.硅是良好的半导体材料,二氧化硅可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是( )
![]()
A. 原子半径Z<M
B. 非金属性:X<Z
C. M元素最高价氧化物对应水化物具有两性
D. Y的最高价氧化物对应水化物的酸性比X的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com