
【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
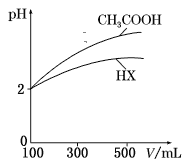
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
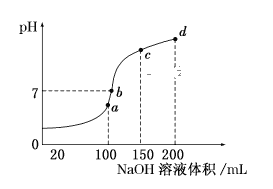
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。
【答案】10-12 CO32-+H2O![]() OH-+HCO3- 10-3 小于 稀释相同的倍数,一元酸HX的pH变化比CH3COOH小 cab NaCN+CO2+H2O=NaHCO3 +HCN 碱 a (Na+)>(SO42-)>(NH4+)>(OH-)=(H+)
OH-+HCO3- 10-3 小于 稀释相同的倍数,一元酸HX的pH变化比CH3COOH小 cab NaCN+CO2+H2O=NaHCO3 +HCN 碱 a (Na+)>(SO42-)>(NH4+)>(OH-)=(H+)
【解析】
(1)纯水在T℃时,pH=6,说明此时水的离子积常数为10-12,该温度下1molL-1的NaOH溶液中,氢离子由水电离产生;
(2)由水电离出的c(OH-)等于溶液中氢氧根离子的浓度;
(3)根据图象可知,稀释相同倍数时,一元酸HX的pH变化量比CH3COOH的小,这说明HX存在电离平衡,因此HX为弱酸,并且酸性比CH3COOH还弱;
(4)①电离常数越大酸性越强,酸性越弱相应的钠盐越容易水解,等pH的NaCN溶液、Na2CO3溶液和CH3COONa溶液中,越容易水解,浓度越小;
②强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小;
③NaCN水解显碱性;HCN电离显酸性,两者混合,因HCN的电离能力比CN-离子的水解能力弱,所以溶液显碱性;
(5)酸或碱抑制水电离,含有弱离子的盐促进水电离,以此解答。
(1)纯水在T℃时,pH=6,即c(H+)=c(OH-)=10-6,可知Kw=10-12,1mol·L-1的NaOH溶液中c(OH-)=1mol/L,由水电离出的c(OH-)取决于溶液中的c(H+),即c(OH-)水=c(H+)= ![]() =10-12mol·L-1;
=10-12mol·L-1;
(2)25 ℃时,向水中加入少量碳酸钠固体,碳酸根水解,得到pH为11的溶液,c(H+)=10-11mol/L,则其水解的离子方程式为CO32-+H2O![]() HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=
HCO3-+OH-,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=![]() =
= ![]() mol/L=10-3mol·L-1;
mol/L=10-3mol·L-1;
(3)根据图象可知,稀释相同倍数时,一元酸HX的pH变化量比CH3COOH的小,这说明HX存在电离平衡,因此HX为弱酸,并且酸性比CH3COOH还弱,故HX的电离常数小于CH3COOH的电离常数,理由是:稀释相同的倍数,一元酸HX的pH变化比CH3COOH小;
(4)①电离常数越大酸性越强,酸性越弱相应的钠盐越容易水解。根据表中数据可知酸性强弱顺序为CH3COOH>H2CO3>HCN>HCO3-,所以25 ℃时,等pH的NaCN溶液、Na2CO3溶液和CH3COONa溶液中,越容易水解,浓度越小,三溶液的浓度由大到小的顺序为CH3COONa>NaCN>Na2CO3,正确答案是:cab;
②强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小。其中Na2CO3对应的是K2=5.6×10-11,H2CO3的K1大于K(HCN),K2小于K(HCN),因此向NaCN溶液中通入少量的CO2,产物应是NaHCO3,方程式为:NaCN+CO2+H2O=NaHCO3 +HCN;
③NaCN水解显碱性;HCN电离显酸性,两者混合,因HCN的电离能力比CN-离子的水解能力弱,所以溶液显碱性;
(5)酸或碱抑制水电离,含有弱离子的盐促进水电离,a点溶质为 (NH4)2SO4、Na2SO4;/span>b点溶质为(NH4)2SO4、Na2SO4、NH3H2O,但一水合氨浓度小于c点;c点溶质为(NH4)2SO4、Na2SO4、NH3H2O,但一水合氨浓度小于d点,d点溶质为Na2SO4、NH3 H2O,溶液中酸浓度或碱浓度越大,抑制水电离程度越大,所以a点促进水电离、bcd点抑制水电离,且抑制水电离程度b<c<d,则水的电离程度最大点是a点;b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是

A. 铁丝在两处的腐蚀速率:a < b
B. a、b两处相同的电极反应式为Fe-2e-==Fe2+
C. 一段时间后,a处液面高于b处液面
D. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】樱桃是一种抗氧化的水果,樱桃中含有一种羟基酸,其结构如图,下列有关该羟基酸的说法中不正确的是
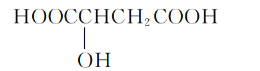
A.该羟基酸的分子式为C4H6O5
B.该羟基酸可发生氧化反应
C.该羟基酸可发生取代反应
D.0.1mol该羟基酸完全燃烧时消耗6.72L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |
(1)盐酸的物质的量浓度为_____。
(2)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_____(填“偏高”或“偏低”或“无影响”)。
(3)下列有关实验的说法正确的是______。
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水中的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比9∶11混合,则混合液的pH=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.![]() 的体积分数:
的体积分数:![]()
D.容器I和容器II中![]() 的体积分数相同
的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是一个电化学过程的示意图。
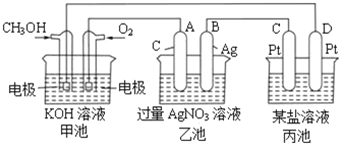
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式______。
(2)乙池中反应的化学方程式为__________________,当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为______L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是______(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。
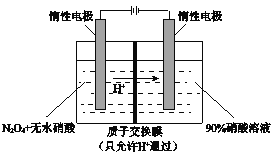
阳极区生成N2O5的电极反应式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2))是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。某课题组以惰性电极电解盐酸和NH4Cl的混合溶液获得NCl3溶液,再以NCl3溶液和NaClO2反应制得ClO2。回答下列问题:
(1)ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示:
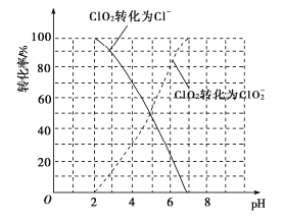
①pH≤2时,ClO2与I-反应生成I2的离子方程式为_________________。
②在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+,ClO2氧化Mn2+生成MnO2的反应中,氧化剂和还原剂的物质的量之比为________。
(2)NCl3的水解产物有NHCl2、NH2Cl等。
①NCl3的电子式为________,其中氯元素的化合价是________;NH2Cl仍可缓慢发生水解,其化学方程式为_________________。
②NCl3在NaOH溶液中水解生成N2,NaClO和NaCl,其化学方程式为______________。
③NCl3与NaClO2按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2和氨,该反应的离子方程式为___________________。
(3)有下列两种方法制备ClO2:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是_______________。
(4)电解获得NCl3溶液的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓是一种广泛用于电子和通信领域的重要金属,其化学性质与铝相似。
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为________。
②GaO2— 在阴极放电的电极反应式为______。
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为______。
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是______(填字母)。
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液:K+、Fe3+、SO42-、Cl-
B.水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32-
C.与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42-
D.![]() = 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
= 1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com