
【题目】Ⅰ.如图是一个电化学过程的示意图。
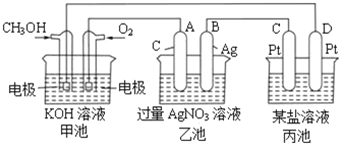
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式______。
(2)乙池中反应的化学方程式为__________________,当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为______L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是______(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。
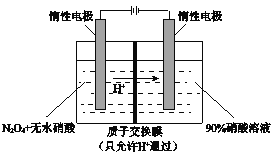
阳极区生成N2O5的电极反应式是___________________________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O4AgNO3+2H2O![]() 4Ag+O2↑+4HNO30.28BN2O4-2e-+2HNO3=2N2O5+2H+
4Ag+O2↑+4HNO30.28BN2O4-2e-+2HNO3=2N2O5+2H+
【解析】
试题Ⅰ.(1)甲醇失去电子,据此书写电极反应式;
(2)根据正负极判断阴阳极,据此书写电解硝酸银溶液的反应式;根据电子得失守恒分析计算和判断;
Ⅱ.阳极发生失去电子的氧化反应。
解析:Ⅰ.(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动。该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解AgNO3溶液,电解方程式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;当乙池中B(Ag)极质量增加5.4 g,得到的电子的物质的量为
4Ag+O2↑+4HNO3;当乙池中B(Ag)极质量增加5.4 g,得到的电子的物质的量为![]() mol=0.05 mol,由电子守恒可知,生成氧气的物质的量为
mol=0.05 mol,由电子守恒可知,生成氧气的物质的量为![]() mol=0.0125 mol,在标准状况下的体积为0.0125 mol×22.4 L/mol=0.28 L。此时丙池中某电极析出1.6 g某金属,设该金属为+2价金属,则M=1.6 g÷(0.5 mol/2)=64 g/mol,则该金属为Cu,如果是+1价,则相对原子质量=1.6÷0.05=32答案选B。
mol=0.0125 mol,在标准状况下的体积为0.0125 mol×22.4 L/mol=0.28 L。此时丙池中某电极析出1.6 g某金属,设该金属为+2价金属,则M=1.6 g÷(0.5 mol/2)=64 g/mol,则该金属为Cu,如果是+1价,则相对原子质量=1.6÷0.05=32答案选B。
Ⅱ.阳极发生失去电子的氧化反应,NO2在阳极失去电子结合硝酸根转化为N2O5,电极反应式为N2O4-2e-+2NO3-=2N2O5。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理的离子方程式是( )
A.用明矾作净水剂:Al3++3H2O![]() Al(OH)3↓+3H+
Al(OH)3↓+3H+
B.氯气通入水中,溶液呈酸性:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.酚酞滴入碳酸钠溶液中,溶液变红:CO32- + 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4 + CO32-=CaCO3 + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题:
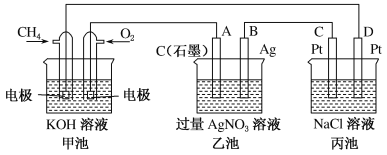
(1)甲池是_____装置,乙装置中电极A的名称是______。
(2)甲装置中通入CH4的电极反应式为_____,乙装置中电极B(Ag)的电极反应式为_____,丙装置中D极的产物是_____(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=_____。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入_______(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)纯水在100℃时pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=__mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为__,由水电离出的c(OH-)=___mol·L-1。
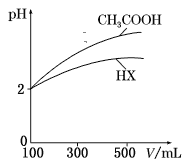
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离常数___(填“大于”“小于”或“等于”)CH3COOH的电离常数。理由是___。
(4)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等pH的a.NaCN溶液、b.Na2CO3溶液和c.CH3COONa溶液,三溶液的浓度由大到小的顺序为___。(用a、b、c表示)
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___。
③25℃时,等浓度的HCN和NaCN混合溶液显___性。(酸、碱、中)
(5)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
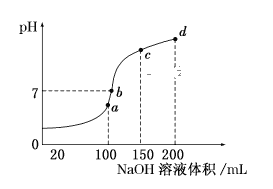
试分析图中a、b、c、d四个点,水的电离程度最大的是__;在b点,溶液中各离子浓度由大到小的排列顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某酸H3A水溶液滴加KOH溶液,混合溶液中lgX随pH变化关系如图所示,图中X表示![]() 或
或![]() 或
或![]() 。下列说法正确的是( )
。下列说法正确的是( )
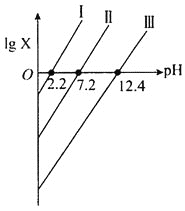
A.Ka2(H3A)的数量级为10-7
B.曲线Ⅰ表示pH与lg![]() 的变化关系
的变化关系
C.向H3A溶液中加入一定量的KOH溶液至pH=5时,![]() =100.6
=100.6
D.KH2A与K2HA等物质的量混合的溶液中:3c(K+)=2[c(H2A-)+c(HA2-)+c(A3-)+c(H3A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用邻苯二酚为原料,利用下列方法合成农药克百威的主要中间体——呋喃酚。
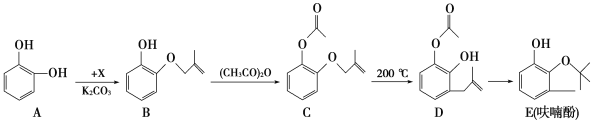
(1)邻苯二酚苯环上的一氯代物共有________种;已知X属于氯代烃,则X的分子式为________。
(2)呋喃酚中含有的官能团名称是________。
(3)用________鉴别C和D,C能够发生的反应有________(填序号)。
a.加成反应 b.取代反应 c.氧化反应 d.消去反应
(4)与A互为同系物,且碳原子数比A多1,分子结构中含有一个-CH3的同分异构体有________种;N与E互为同分异构体,且N含有酯基和苯环,能发生银镜反应且苯环上只有一种等效氢,写出N的一种结构简式:__________。
(5)请设计合理方案用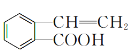 合成
合成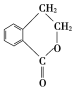 (用反应流程图表示,并注明反应条件)。例:由乙醇合成聚乙烯的反应流程图可表示为
(用反应流程图表示,并注明反应条件)。例:由乙醇合成聚乙烯的反应流程图可表示为![]()
![]() 。_____________
。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据核外电子的排布特点推断元素的性质:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为_____,在周期表中位于___区。
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为_______。
(3)请利用电子排布的相关知识稳定性:Fe3+______Fe2+(填>或< ),原因___________,第一电离能:Mg____Al(填>或< )原因__________。
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是______;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是_____;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______;
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(共7分)依据氧化还原反应:
2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填电极材料名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com