
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A.1.4 g乙烯和丙烯混合气体中含有C—H键的数目为0.2NA
B.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA
C.标准状况下,11.2 L CO2与足量Na2O2反应,转移的电子数为NA
D.若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA
【答案】A
【解析】
A.乙烯和丙烯的最简式相同,都是CH2,1.4 g CH2的物质的量是0.1 mol,含有C—H键的数目为0.2NA,A正确;
B.0.10 mol Fe粉与足量水蒸气反应,方程式是3Fe+4H2O(g)![]() Fe3O4+4H2,生成的H2分子数约为0.13NA,B错误;
Fe3O4+4H2,生成的H2分子数约为0.13NA,B错误;
C.根据方程式:2Na2O2+2CO2=2Na2CO3+O2,2 mol CO2参与反应,转移电子数为2NA,标准状况下,11.2 L CO2与足量Na2O2反应,转移的电子数为0.5NA,C错误;
D.氢氧化铁胶体中胶体粒子是多个氢氧化铁聚合在一起,故将1 mol氯化铁完全转化为氢氧化铁胶体,分散系中胶体粒子数小于NA,D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
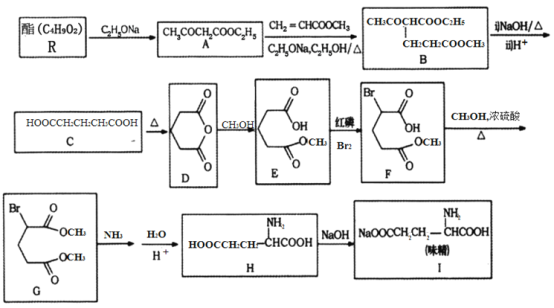
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(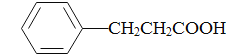 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(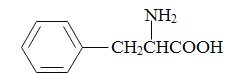 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不法商贩利用“豆浆粉精”勾兑新鲜豆浆被媒体曝光。据悉,这种豆浆完全没有营养价值,“豆浆粉精”中的乙基香兰素(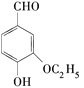 )过量食用还可能导致头痛、恶心、呕吐、呼吸困难,甚至能够损伤肝、肾,对人体有较大的危害。则下列关于乙基香兰素的说法错误的是 ( )
)过量食用还可能导致头痛、恶心、呕吐、呼吸困难,甚至能够损伤肝、肾,对人体有较大的危害。则下列关于乙基香兰素的说法错误的是 ( )
A.乙基香兰素的分子式为C9H10O3
B.乙基香兰素与苯甲醛互为同系物
C.乙基香兰素的同分异构体可能含有酯基
D.乙基香兰素能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.糖类、油脂、蛋白质均只含C、H、O三种元素
B.乙烯,乙醇、植物油均能使酸性高锰酸钾溶液褪色
C.2 -苯基丙烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
D.二环[1,1,0]丁烷(![]() )的二氯代物有3种(不考虑立体异构)
)的二氯代物有3种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+![]() O2(g)
O2(g)![]() CO(g) H4=-111kJ/mol
CO(g) H4=-111kJ/mol
②H2(g)+![]() O2(g)=H2(g) H2=-242kJ/mol
O2(g)=H2(g) H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) H2=-394kJ/mol
下列说法不正确的是( )
A.25℃时,![]()
B.增大压强,反应①的平衡向逆反应方向移,平衡常数K减小
C.反应①达到平衡时,每生成![]() 的同时生成0.5molO2
的同时生成0.5molO2
D.反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如图所示:

已知:2
回答下列问题:
(1)A的化学名称是____,B中官能团的名称是____,由A生成B的反应类型是____ 。
(2)写出C所有可能的结构简式____;
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A及不超过两个碳原子的有机物及合适的无机试剂为原料,经两步反应合成D。其合成路线为:_____;
(合成路线流程图示例如下:H2C=CH2![]() CH3CH3Br
CH3CH3Br![]() CH3CH2OH)
CH3CH2OH)
(4)由E可合成一种聚酯类高分子化合物F。
①1molE与足量饱和NaHCO3溶液反应可放出____LCO2(标况);
②由E合成F的反应类型为____,该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com