
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���ȼ�ϡ�
I.��ҵ������CO����ȼ�ϼ״�����֪2H2(g)+CO(g) CH3OH(g)����
��1���ں��º��ݵĸ��������н��и÷�Ӧ����˵���ﵽƽ��״̬����____��(ѡ����ĸ���)
a.��������ܶȲ��ٸı�
b.�������ƽ��Ħ���������ٸı�
c.H2��CO��CH3OH��Ũ��֮��Ϊ2��1��1
d.��λʱ��������1molCO��ͬʱ����2molH2
��2�����ܱ������а����ʵ���֮��Ϊ2:1����H2��CO�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯�����ͼ1��ʾ��
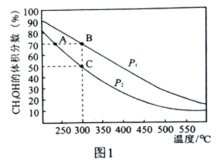
���淴Ӧ���ʣ�v��(A)__v��(B)(�>������<����"=��)
��C��ʱ��H2��ƽ��ת����Ϊ________________���÷�Ӧ��ƽ�ⳣ��Kp=____kPa��2(�ú�p2�Ĵ���ʽ���KPΪ������ƽ���ѹ��������ƽ��Ũ�ȱ�ʾ��ƽ�ⳣ���������ѹ=������ѹ����������ʵ�������)��
II.�״�ˮ������������(SRM)ϵͳ��������H2�����ߡ�CO������(CO����ȼ�ϵ�صĽ���Ĥ)���ǵ綯��������ȼ�ϵ�ص�������Դ����Ӧ���£�
��Ӧi(��)��CH3OH(g)+H2O(g) CO2(g)+3H2(g) ��H1=+49kJ��mol��1
��Ӧii(��)��H2(g)+CO2(g) CO(g)+H2O(g) ��H2=+41kJ��mol��1
�¶ȸ���300��C���ͬʱ������Ӧiii��CH3OH(g) CO(g)+2H2(g) ��H3
��3�������H3=____________.
��4�����½����������CH3OHת���ʣ���Ҳ����һ�����Ե�ȱ����____________��
��5���������Ըı仯ѧ��Ӧ���ʣ���Ҳ������һ�����Խ���������ѡ��������ͼ2Ϊij���������£�CH3OHת���ʡ�CO���������¶ȵı仯��ϵ�������¶ȵ����ߣ�CO��ʵ�ʷ�Ӧ��������ƽ��״̬���������Խ��Խ���ԭ���Ǵ�����____________(������Ӧi����"��Ӧii��)��ѡ���Ե͡�
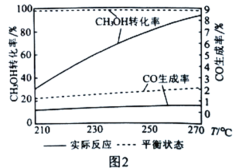
���𰸡�bd �� 75% ![]() +90kJmol-1 CO�������ߣ��ƻ�ȼ�ϵ�صĽ���Ĥ ��Ӧii
+90kJmol-1 CO�������ߣ��ƻ�ȼ�ϵ�صĽ���Ĥ ��Ӧii
��������
��(1)���淴Ӧ����ƽ��ʱ��ͬ�����ʵ�������������ұ��ֲ��䣬����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
(2)���¶���ͬʱ��p1���߶�Ӧ��CH3OH����������ϸߣ���˵������ѹǿƽ�����ƣ���p1��p2����B���¶ȸ���A���¶ȣ�
��C��ʱ��CH3OH���������Ϊ50%��

V(CH3OH)%=![]() ��100%=
��100%=![]() ��100%=50%�����x=0.75��ת������(H2)=
��100%=50%�����x=0.75��ת������(H2)=![]() ��100%��ƽ�ⳣ��KP=
��100%��ƽ�ⳣ��KP=![]() ��p(H2)=
��p(H2)=![]() ��p2��p(CO)=
��p2��p(CO)=![]() ��p2��p(CH3OH)=
��p2��p(CH3OH)=![]() ��p2��
��p2��
��(3)��֪����Ӧi(��)��CH3OH(g)+H2O(g)CO2(g)+3H2(g)��H1=+49kJmol-1
��Ӧii(��)��H2(g)+CO2(g)CO(g)+H2O(g)��H2=+41kJmol-1
��ϸ�˹���ɣ���Ӧi+��Ӧii���ɵ÷�Ӧiii��
(4)����CO����������ȼ�ϵ�صĽ���Ĥ������
(5)������ѡ���Է����жϣ������¶ȵ�����һ����̼�����ʵ͡�
��(1)a���÷�Ӧ����������������䣬�������ܶ�Ϊ��ֵ����������ܶȲ��ٸı䲻��˵���ﵽƽ��״̬����a����
b���÷�Ӧ�����������䣬�������ʵ����ı䣬���������ƽ��Ħ������Ϊ�仯ֵ���������ƽ��Ħ���������ٸı����˵���ﵽƽ��״̬����b��ȷ��
c��H2��CO��CH3OH��Ũ��֮��Ϊ2:1:1����˵���ﵽƽ��״̬����c����
d����λʱ��������1molCO��ͬʱ����2molH2����˵���ﵽƽ��״̬����d��ȷ��
�ʴ�Ϊ��bd��
(2)���¶���ͬʱ��p1���߶�Ӧ��CH3OH����������ϸߣ���˵������ѹǿƽ�����ƣ���p1��p2�����B���¶ȸ���A���¶ȣ���v��(A)��v��(B)��
��C��ʱ��CH3OH���������Ϊ50%��

V(CH3OH)%=![]() ��100%=
��100%=![]() ��100%=50%�����x=0.75mol��ת������(H2)=
��100%=50%�����x=0.75mol��ת������(H2)= ![]() =
=![]() ��100%=75%��ƽ�ⳣ��KP=
��100%=75%��ƽ�ⳣ��KP=![]() �� p(H2)=
�� p(H2)=![]() ��p2��p(CO)=
��p2��p(CO)=![]() ��p2��p(CH3OH)=
��p2��p(CH3OH)=![]() ��p2 ��KP=
��p2 ��KP=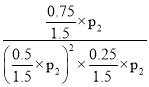 =
=![]() ��
��
��(3)��֪����Ӧi(��)��CH3OH(g)+H2O(g)CO2(g)+3H2(g)��H1=+49kJmol1
��Ӧii(��)��H2(g)+CO2(g)CO(g)+H2O(g)��H2=+41kJmol1
��ϸ�˹���ɣ���Ӧi+��Ӧii���ɵ÷�Ӧiii:CH3OH(g)CO(g)+2H2(g)��H3=(+49+41)kJ/mol=+90kJ/mol��
(4)����������ƽ�����ƣ����CH3OHת���ʣ���CO����������ȼ�ϵ�صĽ���Ĥ��
(5)������ѡ���Է����жϣ������¶ȵ�����һ����̼�����ʵͣ�˵�������Է�Ӧii��ѡ���Բ


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(NH4)2Cr2O7�������л��ϳɴ�����ýȾ�� ����ӰҺ�ȡ� ij��ѧ��ȤС���(NH4)2Cr2O7 �IJ������ʼ���ɽ���̽�� ����֪ ��Cr2O72-(��ɫ)+H2O22 CrO42- (��ɫ)+2H+�� ��ش���������
(1)��ʢ������(NH4)2Cr2O7 ������Թ��У��μ�����ŨKOH��Һ������ ���۲쵽��ʵ��������_______________ ��
(2) Ϊ̽��(NH4)2Cr2O7 (Ħ������Ϊ 252g/mol)�ķֽ���� ������ͼ���Ӻ�װ�ã���A�м���5.040 g ��Ʒ����ʵ�� ��
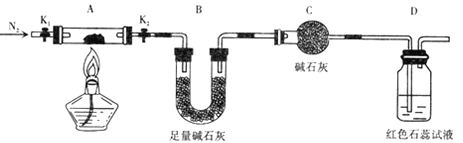
������C��������____________ ��
�����Ӻ�װ�ú�����еı�Ҫ�]���� ________����ȼ�ƾ���֮ǰ����еı�Ҫ�]����
___________________________��
�۷�Ӧ��������ȻҪͨһ��ʱ�䵪����ԭ���� ____________________ ��
�ܼ���A�����أ��۲쵽D����Һ����ɫ��ͬʱ���A�в�����Ϊ Cr2O3 ��B�������仯Ϊ1.44g. д��( NH4)2Cr2O7���ȷֽ�Ļ�ѧ����ʽ��____________��
(3)ʵ���ҳ��ü�ȩ���ⶨ��( NH4)2Cr2O7 ����Ʒ�е�����������(���ʲ�������Ӧ)���䷴Ӧԭ��Ϊ2Ba2++ Cr2O72-+H2O=2BaCrO4��+2H+��4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ �ζ�ʱ l mol(CH2)6N4H+ �� l mol H+ �൱�ݣ�Ȼ���� NaOH����Һ�ζ� ��Ӧ���ɵ��ᡣ
ʵ�鲽�裺��ȡƷ8.400g. ���500mL��Һ����ȡ25.00mL, ��Ʒ��Һ��250mL��ƿ�У����Ȼ�����ҺʹCr2O72- ��ȫ���������15.00mL2 0.00molL-1�����Լ�ȩ��Һ��ҡ �ȡ�����5min ����1- 2 �η�̪��Һ ����0 .2000molL-1 NaOH����Һ�ζ����յ㡣�ظ��������� 3�Σ����յζ���ȥNaOH ����Һ�����ƽ��ֵΪ 30.00mL��
�����ζ��յ�ʱ�����Ӷ�������ⶨ��� ____(�� ��ƫ��ƫС������Ӱ�� ��)��
����Ʒ�е�����������Ϊ _____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��Ϊ�о�ˮ�������ɣ����CaCO3��Mg(OH)2�ܽ��������ͼ��ʾ����֪��40��Cʱ��Ksp(MgCO3)=7��10-6�������йط���������ǣ� ��
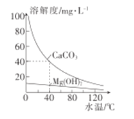
A.CaCO3��Mg(OH)2�ܽ������
B.MgCl2��Һ�м�������CaCO3��ĩ���Ƚ��裬��Mg(OH)2����
C.����Ca(HCO3)2��Mg(HCO3)2������ˮ��ʱ����ȣ�ˮ������Ҫ�ɷ�ΪCaCO3��MgCO3
D.40��ʱ��Ksp(CaCO3)=1.6��10-7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijAl2O3��Ʒ�к���һ������Cu��Fe��Fe2O3���ʡ���ͨ��������������,�Ӹ���Ʒ�л������졣��������:

��1������a��________����ʵ���ҽ��иò�����Ҫ�IJ����������ձ���©����_______��
��2���Լ�����_______,����II��_________���ѧʽ����
��3�����ɫ�����ijɷ���_________��д����ɫ����ת��Ϊ���ɫ�����Ļ�ѧ����ʽ:______________��
��4����ҺII����Ԫ�صĴ�����ʽ��_______�������ӷ������������ʵ��֤��:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
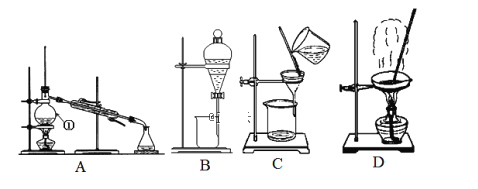
��(1)�ӵ�ˮ�з����I2��ѡ��װ��_______���÷��뷽��������Ϊ_________��
(2)д����ͼ�������ٵ�����___________________ ��
(3)����������ȴˮ�ķ���Ϊ________________________ ��
��ʵ����Ҫ����2mol/Lϡ����240mL��
(1)��ȡ18.4mol/L��Ũ����ʱ�����������ֹ�����Ͳ___(�����)
��10mL ��50mL ��100mL ��500mL
(2)���Ƹ�ϡ����ʱʹ�õ���������Ͳ���ձ��⣬�������õ��������в���������ͷ�ιܡ�________��
(3)�����ƹ����У���������������������������Һ�����ʵ���Ũ���к�Ӱ�죿(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)
������Ͳ��ȡŨ����ʱ��������Ͳ���ж���________��
�ڶ���ʱ��Һ�泬���̶��ߺ��ý�ͷ�ι�����Һ�洦______��
��.200mL 5mol/L NaOH��Һ�У�ȡ��20mL��Һ�������ʵ�������___________����ȡ������Һϡ����100mL�������ʵ����ʵ���Ũ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. ����Ͷ��NaOH��Һ�У�2Al��2OH��===2AlO2-��H2��
B. Na��CuSO4��Һ��Ӧ��Cu2����2Na===2Na����Cu
C. ��AlCl3��Һ�м��������İ�ˮ��Al3����3OH��===Al(OH)3��
D. Ba(OH)2��Һ��ϡ���ᷴӦ��Ba2����2OH����2H����SO42-===BaSO4����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������У�VSEPR(�۲���ӶԻ�������)ģ����������ӻ����ӵĿռ乹�����Ʋ�һ�µ���
A.CO2B.CO32-C.H2OD.CC14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������3���Ȼ�ѧ����ʽ��H2(g)+![]() O2(g)= H2O(g) ��H=a kJ/mol��H2(g)+
O2(g)= H2O(g) ��H=a kJ/mol��H2(g)+ ![]() O2(g)= H2O(l) ��H=b kJ/mol��2H2(g) +
O2(g)= H2O(l) ��H=b kJ/mol��2H2(g) + ![]() O2(g)= 2H2O(l) ��H=c kJ/mol���������ǵ����б�����ȷ���ǣ�
O2(g)= 2H2O(l) ��H=c kJ/mol���������ǵ����б�����ȷ���ǣ�
A.���Ƕ������ȷ�ӦB.a��b��c��Ϊ��ֵC.a=bD.c=2b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ�ص���±ˮ(��Cl����Br����Na����Mg2��)��װ������ͼ��ʾ(a��bΪʯī�缫)������˵���У���ȷ����
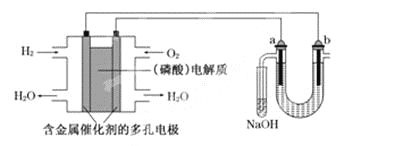
A. ��ع���ʱ��������ӦʽΪ�� O2��2H2O��4e��===4OH��
B. ���ʱ��a�缫��Χ���ȷŵ����Br��������Cl����˵��������������ͬʱǰ�ߵĻ�ԭ��ǿ�ں���
C. ���ʱ����������·���ǣ����������·����������Һ������������
D. ����������ģ������������0.02 g H2ʱ��b����Χ�����0.04 g H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com