
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂 、显影液等。 某化学兴趣小组对(NH4)2Cr2O7 的部分性质及组成进行探究 。已知 :Cr2O72-(橙色)+H2O22 CrO42- (黄色)+2H+。 请回答下列问题
(1)向盛有少量(NH4)2Cr2O7 固体的试管中.滴加足量浓KOH溶液.振荡、微热 ,观察到的实验现象有_______________ 。
(2) 为探究(NH4)2Cr2O7 (摩尔质量为 252g/mol)的分解产物 .按下图连接好装置,在A中加入5.040 g 样品进行实验 。
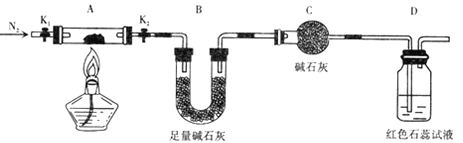
①仪器C的名称是____________ 。
②连接好装置后需进行的必要橾作是 ________,点燃酒精灯之前需进行的必要橾作是
___________________________。
③反应结束后.依然要通一段时间氮气的原因是 ____________________ .
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为 Cr2O3 ,B中质量变化为1.44g. 写出( NH4)2Cr2O7加热分解的化学方程式:____________。
(3)实验室常用甲醛法测定含( NH4)2Cr2O7 的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++ Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ 滴定时 l mol(CH2)6N4H+ 与 l mol H+ 相当].然后用 NaOH标准溶液滴定 反应生成的酸。
实验步骤:称取品8.400g. 配成500mL溶液,移取25.00mL, 样品溶液于250mL锥形瓶中.用氯化钡溶液使Cr2O72- 完全沉淀后加入15.00mL2 0.00molL-1的中性甲醛溶液,摇 匀、静置5min 后,加入1- 2 滴酚酞试液 ,用0 .2000molL-1 NaOH标准溶液滴定至终点。重复上述操作 3次,最终滴定用去NaOH 标准溶液体积的平均值为 30.00mL。
①若滴定终点时,仰视读数。则测定结果 ____(填 “偏大”“偏小”或“无影响 ”)。
②样品中氮的质量分数为 _____________ 。
【答案】固体溶解,产生无色、有刺激性气味的气体,溶液由橙色变为黄色 (球形) 干燥管 检查装置的气密性 通入氮气一段时间将装置内空气排尽 将A中分解产生的气体全部赶入B中 ,防止产生实验误差 (NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O 偏大 10.00%
Cr2O3+N2↑+4H2O 偏大 10.00%
【解析】
(1)根据加入碱对平衡Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+的影响,结合铵根离子的性质分析解答;
(2)①根据仪器C的结构分析判断;
②根据装置内存在空气分析解答;
③反应结束后,装置中仍残留少量生成的气体;
④加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,为吸收的水蒸气,结合定量关系计算写出化学方程式;
(3)根据沉淀重铬酸根离子生成氢离子2xmol,铵根离子和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,利用氢离子物质的量和氢氧根物质的量相同计算解答。
(1)在试管中加入少量(NH4)2Cr2O7固体,溶液中存在滴加足量浓KOH溶液,振荡、微热,铵根离子与碱反应放出氨气、氢离子浓度减小,溶液中的Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+平衡正向进行,溶液显黄色,因此观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色,故答案为:固体溶解;产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
(2)①根据装置图,仪器C为球形干燥管,故答案为:球形干燥管;
②连接好装置,需进行的必要操作是检查装置的气密性,点燃酒精灯之前,需要通入一段时间氮气,将装置内空气排尽,故答案为:检查装置的气密性;通入氮气一段时间将装置内空气排尽;
③反应结束后,依然通一段时间的氮气,可以将A中分解产生的气体全部赶入B中,防止产生实验误差,故答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
④(NH4)2Cr2O7(摩尔质量为252g/mol)的分解产物,在A中加入5.040g样品,物质的量=![]() =0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3,B中质量的变化为1.44g,为吸收的水蒸气物质的量=
=0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3,B中质量的变化为1.44g,为吸收的水蒸气物质的量=![]() =0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7
=0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7
Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O;
Cr2O3+N2↑+4H2O;
(3)①若滴定终点时,仰视读数,读取消耗氢氧化钠溶液增大,则测定结果偏大,故答案为:偏大;
②反应原理为2Ba2++Cr2O72-+H2O=2BaCrO 4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸,设25.00 mL样品溶液中含有(NH4)2Cr2O7的物质的量为x,则沉淀重铬酸根离子时生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,用0.200mo1L-1 NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为30.00mL,2x+2x=0.030L×0.200mol/L,解得:x=0.0015mol,则原样品中含有(NH4)2Cr2O7的物质的量为0.0015mol×![]() =0.03mol,该样品中氮的质量分数=
=0.03mol,该样品中氮的质量分数=![]() ×100%=10.00%,故答案为:10.00%。
×100%=10.00%,故答案为:10.00%。


科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
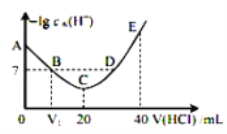
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。根据下列反应回答问题:
A.![]()
B.![]()
C.![]()
D.![]()
(1)上述反应中,H2O2仅体现氧化性的反应是(填序号,下同)_________,H2O2仅体现还原性的反应是(填序号,下同)_________,H2O2既体现氧化性又体现还原性的反应是________。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序是________
(3)某酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:![]() 。已知该反应中H2O2只发生了如下过程:H2O2→O2。
。已知该反应中H2O2只发生了如下过程:H2O2→O2。
①写出上述反应的离子方程式并配平_______________________________________
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子为_______mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),发生以下反应:![]() ,试指出生成物A的化学式为________。
,试指出生成物A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题 :
(1) 第三周期的某主族元素.其第一至第五电离能数据如图1所示.则该元素对应的原子有___________种不问运动状态的电子。
(2)如图2所示.每条折线表示周期表IVA–VIIA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是________。判断依据是__________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该CO2晶体属于_____晶体。
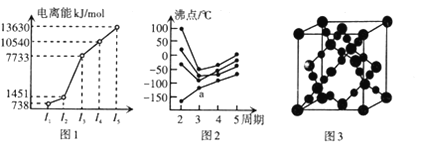
(4) 第一电离能介于Al、P之间的第三周期元素有_____ 种。CaCl3中Ca原子的杂化力式为_______,写出一种与CaCl3且为电子体的离子的化学式_________ 。
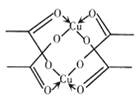
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性.而干冰、碘的晶体具有相似的结构特征 ,干冰晶体中一个分子周围有______个紧邻分子。醋酸铜晶体局部结构如右图,该晶体中含有的化学键是____________(填字母标号)。
a 极性键 b非极性键 c 配位键 d. 金属键
(6) Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图示中正确的是_____ (填字母标号)。
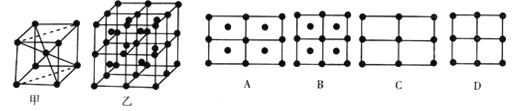
铁原子的配位数是__________,假设铁原于的半径是r cm.,该晶体的密度是ρg/cm3 则铁的相对原子质量为______________ (设阿伏加德罗常数的值为NA) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(![]() )中含有的共价键数为0. 3 NA
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
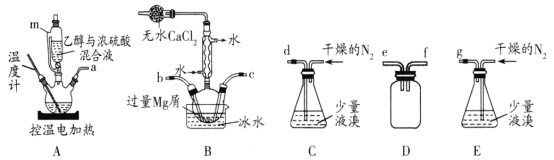
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是____。
(2)步骤I中所选装置的正确连接顺序是a ___ (填小写字母),装置D的作用是___。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是____。
(4)实验中不能用干燥空气代替干燥N2,原因是_______;
(5)有关步骤V的说法,正确的是_______;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-, Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为_______.
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0. 0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 00 mL,则测得无水MgBr2产品的纯度是_________(以质量分数表示)。
(7)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到待测样品,_____________________。(补全实验操作)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作燃料。
I.工业上利用CO生产燃料甲醇。已知2H2(g)+CO(g) CH3OH(g),则:
(1)在恒温恒容的刚性容器中进行该反应,能说明达到平衡状态的是____。(选填字母序号)
a.混合气体密度不再改变
b.混合气体平均摩尔质量不再改变
c.H2、CO、CH3OH的浓度之比为2:1:1
d.单位时间内消耗1molCO的同时生成2molH2
(2)在密闭容器中按物质的量之比为2:1充入H2和CO,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示。
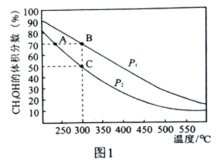
①逆反应速率:v逆(A)__v正(B)(填“>”、“<”或"=”)
②C点时,H2的平衡转化率为________________,该反应的平衡常数Kp=____kPa-2(用含p2的代数式表达,KP为用气体平衡分压代替气体平衡浓度表示的平衡常数,气体分压=气体总压×气体的物质的量分数)。
II.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池的理想氢源。反应如下:
反应i(主):CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H1=+49kJ·mol-1
反应ii(副):H2(g)+CO2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
温度高于300°C则会同时发生反应iii:CH3OH(g) CO(g)+2H2(g) △H3
(3)计算△H3=____________.
(4)升温将有利于提高CH3OH转化率,但也存在一个明显的缺点是____________。
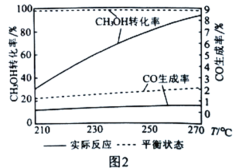
(5)催化剂可以改变化学反应速率,但也存在着一种特性叫“催化剂的选择性”。图2为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。随着温度的升高,CO的实际反应生成率与平衡状态生成率相差越来越大的原因是催化剂对____________(填“反应i”或"反应ii”)的选择性低。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com