
【题目】教材插图具有简洁而又内涵丰富的特点。请回答以下问题 :
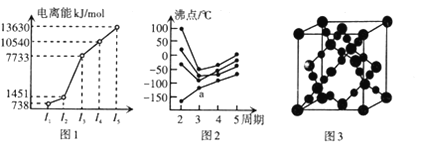
(1) 第三周期的某主族元素.其第一至第五电离能数据如图1所示.则该元素对应的原子有___________种不问运动状态的电子。
(2)如图2所示.每条折线表示周期表IVA–VIIA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是________。判断依据是__________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该CO2晶体属于_____晶体。
(4) 第一电离能介于Al、P之间的第三周期元素有_____ 种。CaCl3中Ca原子的杂化力式为_______,写出一种与CaCl3且为电子体的离子的化学式_________ 。
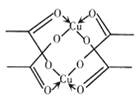
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性.而干冰、碘的晶体具有相似的结构特征 ,干冰晶体中一个分子周围有______个紧邻分子。醋酸铜晶体局部结构如右图,该晶体中含有的化学键是____________(填字母标号)。
a 极性键 b非极性键 c 配位键 d. 金属键
(6) Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图示中正确的是_____ (填字母标号)。
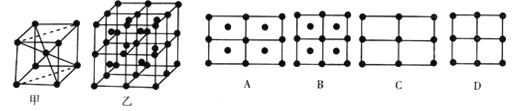
铁原子的配位数是__________,假设铁原于的半径是r cm.,该晶体的密度是ρg/cm3 则铁的相对原子质量为______________ (设阿伏加德罗常数的值为NA) 。
【答案】12 SiH4 在IVA~VIIA的氢化物中.只有IVA族元素氢化物沸点不存在反常现象,且a为第三周期氢化物 ,故 a 为SiH4 原子 3 sp2杂化 CO32- 12 abc A 8 ![]()
【解析】
(1)图1中,I2 与I3相差较大,该元素原子最外层有两个电子,应是第三周期主族元素镁(Mg),电子的运动状态取决于电子所处的能层、能级、原子轨道和自旋方向,镁原子核外共有12个电子,则有12种不同运动状态的电子,故答案为:12;
(2)第ⅣA ~ⅦA元素的氢化物中,NH3、H2O、HF的分子间有氢键,使得它们的沸点与同族其它元素的氢化物相比“反常”,图2中a点所在折线无“反常”,为第IVA元素的氢化物,a点代表的是第三周期的氢化物SiH4,故答案为:SiH4;在IVA~VIIA的氢化物中只有IVA族元素氢化物沸点不存在反常现象,且a为第三周期氢化物;
(3)图3中,C、O原子通过共价键形成空间网状晶体,属于原子晶体,故答案为:原子;
(4)第IIA族元素np能级全空、第VA族元素np能级半充满,使第一电离能出现“反常”,第三周期元素第一电离能由小到大的顺序为Na、Al、Mg、Si、S、P、Cl、Ar,介于Al、P之间的有Mg、Si、S三种元素,Ga位于第四周期第IIIA族,GaCl3分子中,Ga原子价层电子对数为(3+1×3)/2=3,则其杂化方式为sp2,写与GaCl3互为等电子体的离子,可在价电子总数不变的前提下,将Ga、Cl换成它们的邻族元素,如CO32-等,故答案为:3;sp2杂化;CO32-;
(5)干冰晶胞为面心立方堆积,若考察上表面的面心二氧化碳分子,则它与上表面的四个顶点、前后左右四个面心、以及上面一个晶胞的前后左右四个面心,共12个二氧化碳分子距离最近且相等。从D的醋酸盐晶体局部结构看,该晶体中有C-H、C-O、C=O、O-D等极性键,有C-C非极性键,有O→D配位键,故答案为:abc;
(6)图甲为该铁的一个晶胞,沿虚线的切面为长方形,长是宽的![]() 倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图,考察图甲体心铁原子,则其配位数为8,设图甲中晶胞边长为a cm,则体对角线为
倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图,考察图甲体心铁原子,则其配位数为8,设图甲中晶胞边长为a cm,则体对角线为![]() a cm。又体对角线上三原子相切,得
a cm。又体对角线上三原子相切,得![]() a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=
a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=![]() ,解得M(Fe)=
,解得M(Fe)=![]() g/mol,Mr(Fe)=
g/mol,Mr(Fe)=![]() ,故答案为:A;8;
,故答案为:A;8;![]() 。
。


科目:高中化学 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将22.70 g小苏打和纯碱晶体(Na2CO3·10H2O)的混合物分成二等份,取其中一份溶于水,配成200 mL溶液,所得溶液中钠离子的物质的量浓度为0.50 mol·L-1;另一份加热至恒重,则固体质量减少( )
A.6.05 gB.5.35 gC.12.10 gD.16.40 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂 、显影液等。 某化学兴趣小组对(NH4)2Cr2O7 的部分性质及组成进行探究 。已知 :Cr2O72-(橙色)+H2O22 CrO42- (黄色)+2H+。 请回答下列问题
(1)向盛有少量(NH4)2Cr2O7 固体的试管中.滴加足量浓KOH溶液.振荡、微热 ,观察到的实验现象有_______________ 。
(2) 为探究(NH4)2Cr2O7 (摩尔质量为 252g/mol)的分解产物 .按下图连接好装置,在A中加入5.040 g 样品进行实验 。
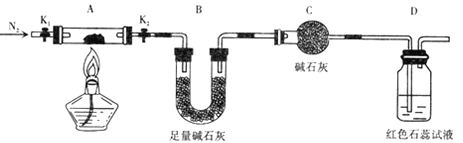
①仪器C的名称是____________ 。
②连接好装置后需进行的必要橾作是 ________,点燃酒精灯之前需进行的必要橾作是
___________________________。
③反应结束后.依然要通一段时间氮气的原因是 ____________________ .
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为 Cr2O3 ,B中质量变化为1.44g. 写出( NH4)2Cr2O7加热分解的化学方程式:____________。
(3)实验室常用甲醛法测定含( NH4)2Cr2O7 的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++ Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ 滴定时 l mol(CH2)6N4H+ 与 l mol H+ 相当].然后用 NaOH标准溶液滴定 反应生成的酸。
实验步骤:称取品8.400g. 配成500mL溶液,移取25.00mL, 样品溶液于250mL锥形瓶中.用氯化钡溶液使Cr2O72- 完全沉淀后加入15.00mL2 0.00molL-1的中性甲醛溶液,摇 匀、静置5min 后,加入1- 2 滴酚酞试液 ,用0 .2000molL-1 NaOH标准溶液滴定至终点。重复上述操作 3次,最终滴定用去NaOH 标准溶液体积的平均值为 30.00mL。
①若滴定终点时,仰视读数。则测定结果 ____(填 “偏大”“偏小”或“无影响 ”)。
②样品中氮的质量分数为 _____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
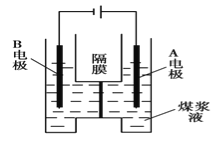
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________。
(2)Mn位于元素周期表的_____区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____。PO43-的空间构型是___,中心原子的杂化方式是______。
(4)PH3是_____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______。
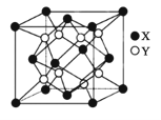
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______nm。(用含a、M、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
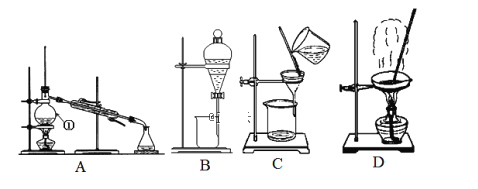
Ⅰ.(1)从碘水中分离出I2,选择装置_______,该分离方法的名称为_________。
(2)写出上图中仪器①的名称___________________ ;
(3)冷凝管中冷却水的方向为________________________ 。
Ⅱ.实验室要配制2mol/L稀硫酸240mL。
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒___(填序号)
①10mL ②50mL ③100mL ④500mL
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有玻璃棒、胶头滴管、________。
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处______;
Ⅲ.200mL 5mol/L NaOH溶液中,取出20mL溶液,其溶质的质量是___________;将取出的溶液稀释至100mL,其溶质的物质的量浓度是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com