
����Ŀ�����������Ҫ�ɷ���Al2O3,����Fe2O3��SiO2����֪SiO2������ˮ��Ҳ����ǿ���ǿ�Ӧ��������,�����в���������������ȡAl2O3���ش���������:

(1)д��������Ļ�ѧʽ:a______; f______��
(2)д���������NaOH��Һʱ��������Ҫ��Ӧ�����ӷ���ʽ:________________��______________��
(3)д��ͨ������B(����)ʱ��ҺC�з�����Ӧ�����ӷ���ʽ:___________________��_______________��
(4)����������Ҫ�Ļ�����,��ѧ��ѧ�������������������������������,�� Fe(OH)2 ת����Fe(OH)3������Ϊ___________________________��ͬʱ��Ԫ�ػ�����������FeSO4��7H2O��һ��dz��ɫ����,�׳��̷�,�����ڴ����������������ӵķ�ˮ�������̷���ij������ˮ(����ǿ����������Cr2![]() O72-)���д�����������������Cr2
O72-)���д�����������������Cr2![]() O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2
O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2![]() O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
���𰸡� SiO2 Al(OH)3 Al3++4OH-![]() Al
Al![]() +2H2O Fe3++3OH-
+2H2O Fe3++3OH-![]() Fe(OH)3�� CO2+Al
Fe(OH)3�� CO2+Al![]() +2H2O
+2H2O![]() Al(OH)3��+HC
Al(OH)3��+HC![]() CO2+OH-
CO2+OH-![]() HC
HC![]() ��ɫ��״����Ѹ�ٱ�ɻ���ɫ���ձ�ɺ��ɫ�� Cr2O72-+6FeSO4��7H2O+10H+=2Cr3++6Fe3++6SO42-+47H2O
��ɫ��״����Ѹ�ٱ�ɻ���ɫ���ձ�ɺ��ɫ�� Cr2O72-+6FeSO4��7H2O+10H+=2Cr3++6Fe3++6SO42-+47H2O
�����������������Ҫ�ɷ���Al2O3������Fe2O3��SiO2������SiO2��ǿ���Ӧ����Ʒ�м���ϡ���ᣬ��������������������Һ��ʣ�����ΪSiO2������������������Һ�м������������������Һ��������������������ƫ��������Һ��ƫ��������Һ��ͨ�������Ķ�����̼�����������������������պ��Ϊ��������
(1)�����Ϸ�����֪��������aΪSiO2������fΪAl(OH)3����ȷ����SiO2��Al(OH)3��
(2) ��������Һ�������������������Һ��Ӧ����ƫ�����ƺ������ƣ���������Һ�����������������Һ��Ӧ�����������������������ƣ���Ӧ�ķ���ʽΪ��Fe3++3OH-![]() Fe(OH)3����Al3++4OH-
Fe(OH)3����Al3++4OH-![]() AlO2-+2H2O����ȷ����Fe3++3OH-
AlO2-+2H2O����ȷ����Fe3++3OH-![]() Fe(OH)3����Al3++4OH-
Fe(OH)3����Al3++4OH-![]() AlO2-+2H2O��
AlO2-+2H2O��
(3) ����������Һ������Ķ�����̼���巴Ӧ����̼�����ƣ�ƫ��������Һ��ͨ�������Ķ�����̼����������������������Ӧ�����ӷ���ʽ��CO2+OH-![]() HCO3-��CO2+ AlO2-+2H2O
HCO3-��CO2+ AlO2-+2H2O![]() Al(OH)3��+HCO3-
Al(OH)3��+HCO3-![]() ��ȷ����CO2+OH-
��ȷ����CO2+OH-![]() HC
HC![]() ��CO2+ AlO2-+2H2O
��CO2+ AlO2-+2H2O![]() Al(OH)3��+ HCO3-��
Al(OH)3��+ HCO3-��
(4) Fe(OH)2������е�������ˮ��Ӧ������������������Ϊ��ɫ��״����Ѹ�ٱ�ɻ���ɫ���ձ�ɺ��ɫ��������������Cr2O72-����ԭΪCr3+����FeSO4��7H2O������Ϊ����������Ӧ�����ӷ��̣�Cr2O72-+6FeSO4��7H2O+14H+=2 Cr3++6Fe3++6 SO42-+49H2O����ȷ�𰸣�Cr2O72-+6FeSO4��7H2O+14H+=2 Cr3++6Fe3++6 SO42-+49H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������е����������ǣ� ��
A. ���ڵ��������� B. ʯī�� C. ������Һ D. ��̬��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��ijϡ��Һ����ˮ���������c��OH����=10��10 molL��1 �� �����йظ���Һ��������ȷ���ǣ� ��
A.����Һһ��������
B.����Һ��c��H+�����ܵ���10��5 molL��1
C.����Һ��pH����Ϊ4Ҳ����Ϊ10
D.����Һ�п��ܳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ƹ��ȿ��Ʊ���������ƣ�Na2S2O3����Na2S2O3����Ҫ�Ļ����ϣ�������ˮ����������Һ�з������·�Ӧ��S2O32-+2H+=S��+SO2��+H2O��ij��ȤС�����Ʊ���������ƾ��壨Na2S2O3��5H2O�������ⶨ��Ʒ�Ĵ��ȡ�װ�����£�����ȥ����װ�ã���
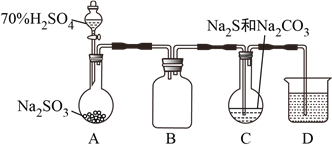
��1��D��β������װ�ã�ʢ�ŵ���Һ������__________��
a�����Ը��������Һ b��NaOH��Һ c������NaHSO3��Һ
��2��C�з����Ļ�ѧ��Ӧ�У�__________��2Na2S+3SO2=2Na2SO3+3S����__________��
��3������ϵ�в�������С��ͬѧ��C���Ƶ���Na2S2O3��5H2O���˾����п��ܻ���Na2SO3��Na2SO4���ʡ���������������ʵ��֤�������������ʵĴ��ڣ�����ɲ�����ȡ������Ʒ���ϡ��Һ���μ�����BaCl2��Һ���а�ɫ�������ɣ�__________������δ��ȫ�ܽ⣬���д̼�����ζ�������������֪Ba2+��S2O32-�����ɳ�������
��4������ͬѧ��������Ϊ������A�еμ�70%��H2SO4�����������彫װ���еĿ����ž�������C����Na2S��Na2CO3�����Һ���ɼ���װ��C�����ɵ�Na2SO4�����������Ľ����Cװ�á�___________

��5���ⶨNa2S2O3��5H2O�Ĵ��ȣ���ȡWg��Ʒ������������ˮ�ܽ⣬�μ�����������Һ����0.1000mol��L-1��ı���Һ�ζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��
���жϷ�Ӧ�ﵽ�ζ����յ�ı�־�ǣ�______________________________��
�ڵζ���ʼ���յ��Һ��λ����ͼ�����Ʒ�Ĵ���Ϊ��Na2S2O��5H2O��Ħ������ΪMg��mol-1��____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ����������������������������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е��������ǣ�
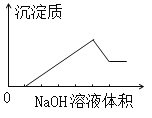
A. Mg2+��Al3+��Fe2+ B. H+��Mg2+��Al3+
C. H+��Ba2+��Al3+ D. ֻ��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ��װ��������֤ijЩ���ʵ����ʣ����Թ�A��װ�������Ĺ���NaHCO3.�Իش��������⣺
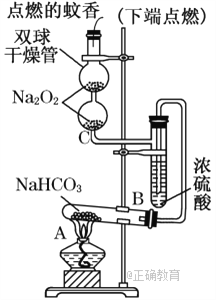
(1)��A�Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ��____________________________________��
(2)Bװ�õ�������_______________________________________________________��
(3)��˫�������ڷ�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(4)˫�������ڹ۲쵽��ʵ��������_________________________________________������ʵ������˵��________________________________________________________��
(5)����������ڵ�Na2O2����Na2O����˫�������ڹ۲쵽��ʵ��������______________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ����Һ�У����й�ϵʽ��ȷ���ǣ� ��
A.c��Cl������c��NH ![]() ����c��H+����c��OH����
����c��H+����c��OH����
B.c��NH ![]() ����c��Cl������c��H+����c��OH����
����c��Cl������c��H+����c��OH����
C.c��Cl����=c��NH ![]() ����c��H+��=c��OH����
����c��H+��=c��OH����
D.c��NH ![]() ��=c��Cl������c��H+����c��OH����
��=c��Cl������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬԪ�ص�ԭ���ڷ������������ӵ�������С����һ��ֵX����ʾ����XԽ����ԭ���������ӵ�����Խǿ�������γɵķ����г�Ϊ�����һ����������ijЩ������Ԫ�ص�Xֵ��
Ԫ�� | Li | Be | B | C | O | F |
Xֵ | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
Ԫ�� | Na | Al | Si | P | S | Cl |
Xֵ | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
��1��ͨ������Xֵ�ı仯���ɣ�ȷ��N��Mg��Xֵ��Χ����X��Mg������ ��X��N���� ��
��2���Ʋ�Xֵ��ԭ�Ӱ뾶�Ĺ�ϵ�� ��
��3��ij�л���ṹ��ʽΪ ![]() ����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
��4��������ɸ������ǵ��ɼ�����ԭ����ӦԪ�ص縺�ԵIJ�ֵ��X��1.7ʱ��һ��Ϊ���Ӽ�������X��1.7ʱ��һ��Ϊ���ۼ������ƶ�AlBr3�л�ѧ����������
��5��Ԥ��Ԫ�����ڱ��У�Xֵ��С��Ԫ��λ����������Ԫ�س��⣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ��/��molL��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c��KOH�� | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
�����жϲ���ȷ���ǣ� ��
A.ʵ��ٷ�Ӧ�����Һ�У�c��K+����c��A������c��OH������c��H+��
B.ʵ��ٷ�Ӧ�����Һ�У�c��OH����=c��K+����c��A����= ![]() mol/L
mol/L
C.ʵ��ڷ�Ӧ�����Һ�У�c��A����+c��HA����0.1 mol/L
D.ʵ��ڷ�Ӧ�����Һ�У�c��K+��=c��A������c��OH����=c��H+��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com