
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):
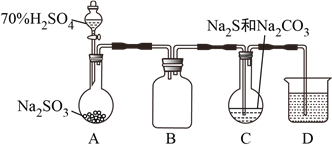
(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

【答案】 ab Na2CO3+SO2=CO2+Na2SO3 Na2SO3+S![]() Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸
Na2S2O3。 过滤后用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸 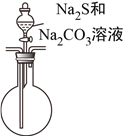 最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色
最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色 ![]() ×100%。
×100%。
【解析】本题考查实验方案设计与评价,(1)SO2是有毒气体,防止污染空气,需要进行尾气处理,利用SO2属于酸性氧化物或具有还原性,进行除去,a、酸性高锰酸钾溶液氧化SO2为SO42-,故a正确;b、SO2与NaOH反应生成Na2SO3,故b正确;c、SO2与NaHSO3不发生反应,不能除去SO2,故c错误;(2)亚硫酸的酸性强于碳酸,因此发生SO2+Na2CO3=Na2SO3+CO2,反应制备硫代硫酸钠晶体,因此发生Na2SO3+S ![]() Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成
Na2S2O3;;(3)实验证明两种杂质的存在,因为S2O32-与Ba2+不生成沉淀,但S2O32-与H+反应生成S和SO2,因此滴加BaCl2溶液有白色沉淀生成后,应过滤,排除S2O32-的干扰,然后向沉淀中加入足量的稀盐酸,沉淀未完全溶解,说明沉淀中有BaSO4,即杂质中含有Na2SO4,由刺激性气味气体产生,此气体为SO2,说明杂质中含有Na2SO3;(4)根据信息,需要先排除装置中空气,防止干扰实验,再向C中加入硫化钠和碳酸钠溶液,因此装置设计成 ;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%=
;(5)①淀粉遇到碘单质变蓝,根据反应原理,滴定至终点的标志为:最后一滴碘液滴入时,溶液由无色变蓝色,且30s内不恢复原来的颜色;②滴定中消耗I2的体积为18.10mL,根据2S2O32-+I2=S4O62-+2I-,n(Na2SO3·5H2O)=2×18.10×10-3×0.1mol,纯度为2×18.10×10-3×0.1×M/W×100%= ![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑
B. 铁粉与氯化铁溶液反应:![]()
C. 氯气与水的反应:Cl2+ H2O ═ 2H+ + Cl- + ClO-
D. 漂白粉溶液中通入过量的CO2:ClO- + CO2 + H2O ═ HClO + HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
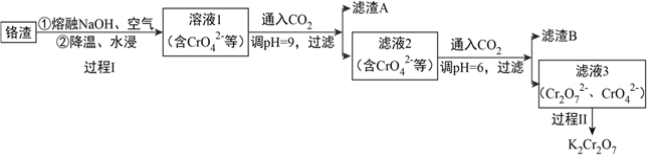
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式: Zn(s)+ ![]() O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
Hg(l)+ ![]() O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为( )
A.﹣260.4 kJmol﹣1
B.﹣441.8 kJmol﹣1
C.+260.4 kJmol﹣1
D.+441.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将 AgCl 放入水中不能导电,故 AgCl 不是电解质
B.CO2溶于水得到的溶液能导电,但 CO2属于非电解质
C.金属能导电,所以金属是电解质
D.液态 HCl 不导电, HCl 属于非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2(已知SiO2不溶于水,也不与强酸和强碱反应)等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题:

(1)写出沉淀物的化学式:a______; f______。
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式:________________、______________。
(3)写出通入气体B(过量)时溶液C中发生反应的离子方程式:___________________、_______________。
(4)铁有许多重要的化合物,中学化学常见的有三种氧化物和两种氢氧化物,则 Fe(OH)2 转化成Fe(OH)3的现象为___________________________。同时铁元素还有许多盐,FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2![]() O72-)进行处理。在酸性条件下Cr2
O72-)进行处理。在酸性条件下Cr2![]() O72-被还原为Cr3+,写出在酸性条件下FeSO4·7H2O与Cr2
O72-被还原为Cr3+,写出在酸性条件下FeSO4·7H2O与Cr2![]() O72-反应的离子方程式:_______________________________________________________________________________
O72-反应的离子方程式:_______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国成为全球首个实现海域成功开采可燃冰的国家,可燃冰是一种甲烷的水合物,下列有关甲烷的说法正确的是
A. 分子式为CH4 B. 极易溶于水 C. 常温下不稳定 D. 是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.![]() ═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在c(OH﹣)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com