
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ��/��molL��1�� | ��Ӧ����Һ��pH | |
c��HA�� | c��KOH�� | ||
�� | 0.1 | 0.1 | 9 |
�� | x | 0.2 | 7 |
�����жϲ���ȷ���ǣ� ��
A.ʵ��ٷ�Ӧ�����Һ�У�c��K+����c��A������c��OH������c��H+��
B.ʵ��ٷ�Ӧ�����Һ�У�c��OH����=c��K+����c��A����= ![]() mol/L
mol/L
C.ʵ��ڷ�Ӧ�����Һ�У�c��A����+c��HA����0.1 mol/L
D.ʵ��ڷ�Ӧ�����Һ�У�c��K+��=c��A������c��OH����=c��H+��
���𰸡�B
���������⣺�����£����������Ũ�ȵ�HA��KOH��ϣ���������仯������Һ�ʼ��ԣ�˵�����������ᣬ A����Һ�д��ڵ���غ㣬��c��K+��+c��H+��=c��A����+c��OH������������ǿ�������Σ�����Һ�ʼ��ԣ�c��OH������c��H+����ˮ�ĵ������������c��A������c��OH��������A��ȷ��
B����Һ�д��ڵ���غ㣬��c��K+��+c��H+��=c��A����+c��OH������c��OH������c��H+��=c��K+����c��A����= ![]() mol/L��10��9 mol/L����B����
mol/L��10��9 mol/L����B����
C���������ʵ�������ͼ�ǡ�÷�Ӧʱ����Һ�ʼ��ԣ�Ҫʹ���������ͼ��Ϻ���Һ�����ԣ������Ũ��Ӧ���ڼ
���������غ��c��A����+c��HA����0.1 mol/L����C��ȷ��
D����Һ�д��ڵ���غ㣬��c��K+��+c��H+��=c��A����+c��OH��������Һ�����ԣ���c��OH����=c��H+������c��K+��=c��A������������Һ��ˮ�ĵ������������c��A������c��OH��������D��ȷ��
��ѡB��
�����£����������Ũ�ȵ�HA��KOH��ϣ���������仯������Һ�ʼ��ԣ�˵�����������ᣬ
A�������ε�����ȷ����Һ������Ũ�ȵ���Դ�С��
B�����ݵ���غ��������������Ũ�ȣ�
C���������ʵ�������ͼ�ǡ�÷�Ӧʱ����Һ�ʼ��ԣ�Ҫʹ���������ͼ��Ϻ���Һ�����ԣ������Ũ��Ӧ���ڼ��Ũ�ȣ�
D�����ݵ���غ�ȷ������Ũ�ȹ�ϵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3,����Fe2O3��SiO2����֪SiO2������ˮ��Ҳ����ǿ���ǿ�Ӧ��������,�����в���������������ȡAl2O3���ش���������:

(1)д��������Ļ�ѧʽ:a______; f______��
(2)д���������NaOH��Һʱ��������Ҫ��Ӧ�����ӷ���ʽ:________________��______________��
(3)д��ͨ������B(����)ʱ��ҺC�з�����Ӧ�����ӷ���ʽ:___________________��_______________��
(4)����������Ҫ�Ļ�����,��ѧ��ѧ�������������������������������,�� Fe(OH)2 ת����Fe(OH)3������Ϊ___________________________��ͬʱ��Ԫ�ػ�����������FeSO4��7H2O��һ��dz��ɫ����,�׳��̷�,�����ڴ����������������ӵķ�ˮ�������̷���ij������ˮ(����ǿ����������Cr2![]() O72-)���д�����������������Cr2
O72-)���д�����������������Cr2![]() O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2
O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2![]() O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�����ϡ���ɫ��ѧ����һ������ǣ�������
A. �ƹ������ʹ�ù�����ͨ���߳���
B. �ոѾ͵ط��գ���������ɱ�
C. ������չ̫���ܺͷ�������
D. ��ȼú����������SO2�Կ�������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�����������Ӧ�������¿��ܴ���������ǣ� ��
A.��ʹpH��ֽ������Һ�У�CO32����K+��Cl����Na+
B.![]() �T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
�T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
C.��c��OH����/c��H+��=1��1012����Һ�У�NH4+��Fe2+��Cl����NO3��
D.��ˮ���������c��OH����=1��10��12mol/L����Һ�У�NO3����Mg2+��Na+��SO42
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ����������������������������NaOH��Һ ����Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е��������ǣ�������
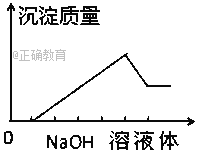
A. Mg2+��Al3+��Fe2+ B. H+��Mg2+��Al3+
C. H+��Ba2+��Al3+ D. ֻ��Mg2+��Al3+
���𰸡�B
������������ͼ���Կ�����Ϊ4���Σ���һ���������ڶ��γ����������ൽ��������������в��ֳ����ܺ��������Ƽ�����Ӧ�������ֳ����ܽ⣬���Ľγ����������������������������������������һ��������˵��ˮ��Һ��һ�����������ӣ���AD���������в��ֳ����ܺ��������Ƽ�����Ӧ��˵�����ֳ���������������ԭ��Һ��һ�����������ӣ����Ľγ�����������������������������������ӣ�˵��һ����һ�ֳ������������Ʋ���Ӧ������֪�ó�����������þ��ԭ��Һ��һ������þ���ӣ�ͭ��������ɫ������Һ��ɫ��������B��ȷ��C����ѡB��
�����͡���ѡ��
��������
14
����Ŀ�����������۷���FeCl3��Һ�У���ȫ��Ӧ����Һ�е�Fe2����Fe3��Ũ����ȣ����ѷ�Ӧ��Fe3����δ��Ӧ��Fe3�������ʵ���֮����( )
A. 2��3 B. 3��2
C. 1��2 D. 1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��1���ֻ����1������������ӳɷ�Ӧ�������ȴ����������ȴ�����1mol����4mol����������ȫ��ȡ����Ӧ��������Ľṹ��ʽΪ��������
A.CH2�TCH2
B.CH3CH�TCH2
C.CH3CH3
D.CH2�TCHCH�TCH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ�������ˮAlCl3(183������)����ʪ������������������������������װ���Ʊ���

��1��װ��B��ʢ��____��Һ��C��F��װ����ͬһ���Լ������Լ�Ϊ________________��
��2��װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��ʵ�鲽������ͼ����װ�ú��ȼ���װ������������װҩƷ��Ȼ���ȼ___________(����A������C��)���ƾ��ƣ���____����ʵ��������ʱ���ٵ�ȼ___________(����A������C��)���ƾ��ơ�
��4��װ��G��������__________________��д��G�з�Ӧ�����ӷ���ʽ_____________________��
��5����ͬѧ��Ϊװ��D��E�м��ϸ�������ܻ��ɴֵIJ�������Ϊʲô?___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�ѧ�仯��ʵ���ǾɵĻ�ѧ�����ѡ��µĻ�ѧ���γ���һ���ۣ��ж����б仯�ǻ�ѧ�仯����
A.�����Ȼ�������ˮB.������������ˮ
C.�������ȱ��ˮ����D.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ98%��Ũ���ᣨ��=l.84g��cm-3������240mLl.84mol��L-1ϡ���ᣬ���в�����ȷ���� ( )
A. ������ˮ����ע��ʢ��һ����Ũ������ձ��У������Ͻ�������ȴ
B. ����Ķ���������100mL��Ͳ��250mL����ƿ��������ƽ
C. ��������ƿ�м�������ˮ�������õ�Ũ����ע������ƿ����ˮ����
D. ��ȡŨ��������Ϊ25.0mL
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com