
����Ŀ��I����ҵ����һ����C02�������״�ȼ�ϵķ�����
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=-49.0kJmol-1
CH3OH(g)+H2O(g) ��H=-49.0kJmol-1
��6 mol CO2��8 mol H2����2 L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ(ʵ��)��ͼ������a(1��6)��ʾ����1 minʱH2�����ʵ�����6 mol��
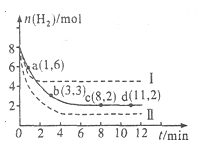
��1��a������Ӧ���� (����ڡ������ڡ���С�ڡ�)�淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ���������� ��
A��O��1 min B��1��3 min C��3��8 min D��8��11 min
��3�����ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯��ͼ����ʾ�����ߣ�������I��Ӧ��ʵ�������ı��� �����ߢ��Ӧ��ʵ�������ı��� ����������ٳ���3molCO2��4 mol H2,H2O(g)��������� ����������䡱��С������
��4������1molCO2��3molH2����������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
��.��ҵ�ϻ����ں����ܱ������в������з�Ӧ�ϳɼ״���CO��g��+2H2��g��![]() CH3OH��g�� ��H
CH3OH��g�� ��H
��1���жϷ�Ӧ�ﵽƽ��״̬�������� ��
A��2v(H2)(��)=v(CO)(��)
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E��������CO��H2��CH3OH��Ũ��֮��Ϊ1:2:1
��2����һ���¶��£�����4a mol H2��2amol CO����2L���ܱ������У���ַ�Ӧ����CO��ת����Ϊ50������÷�Ӧ��ƽ�ⳣ��Ϊ ������ʱ�����������Ͷ��a mol CO��2amol H2��amol CH3OH���ж�ƽ���ƶ��ķ����� ���������ƶ����������ƶ������ƶ���������ԭƽ����ȣ�CO�����ʵ���Ũ�� ������������䡱��С������
���𰸡���1�����ڣ�2��A��3�������¶�������ѹǿ������4��1-a/2
��1��CD��2��1/a2�������ƶ�������
��������
�����������1��a��������������ʵ������ڲ��ϵļ�С�����Է�Ӧ������Ӧ������У��������Ӧ���ʴ����淴Ӧ���ʡ�
��2����Ӧ����Խ��ӳ��������б�ʾ�Խ�����Է�Ӧ����������O��1 min����ѡA��
��3������ͼ���֪����I��Ӧ�ķ�Ӧ���ʿ죬ƽ��ʱ���������ʵ�����˵��ƽ�������淴Ӧ�����ƶ��ģ���˸ı�������������¶ȣ����ߢ�ķ�Ӧ����Ҳ�죬��ƽ��ʱ���������ʵ���С��˵��������Ӧ�����ƶ������������ѹǿ����������ٳ���3molCO2��4 mol H2,�൱������ѹǿ��ƽ��������Ӧ�����ƶ�������ˮ�����ĺ�������
��4����������ʽ���
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ���ʵ��� 1 3 0 0
�仯���ʵ��� a 3a a a
ƽ�����ʵ��� 1-a 3-3a a a
ͬ�¡�ͬ�����ѹǿ�����ʵ������������������ڵ�ѹǿ����ʼѹǿ֮��Ϊ��1-a+3-3a+a+a����4=1-a/2��
��1���жϷ�Ӧ�Ƿ�ﵽƽ������������淴Ӧ������Ⱥ�����Ũ�ȱ��ֲ��䡣�ڸ÷�Ӧ�У�����2v(H2)(��) =v(CO)(��)����v(CO)(��)/ v(H2)(��)=2��1������֮�Ȳ����ڻ�ѧ������֮�ȣ�����˵����Ӧ�Ѵﵽƽ��״̬��A����÷�Ӧ�ں��������н��У���Ӧ�������ﶼ����̬����������������������һֱ���䣬�ܶ�Ҳһֱ���䣬����˵����Ӧ�ﵽƽ��״̬��B��������ʵ������Կ�Ϊ��λʱ��ƽ����Է�����������ֵ�ϵ���ƽ��Ħ��������M=m��n����Ϊ�÷�Ӧ��һ�����������Ŀ�����仯�ķ�Ӧ����������ʵ���Ҳ�ᷢ���仯��ֻ�е���Ӧ�ﵽƽ�����������ʵ����Ų��ٱ仯����ƽ����Է����������ٱ仯����˵����Ӧ�ﵽƽ��״̬��C����ȷ��������Ũ�Ȳ��ٱ仯����Ӧ�ﵽƽ��״̬��D����ȷ����ѡCD��
��2����Ӧ����CO�����ʵ�����2a��50%=amol��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ����2amol 4amol 0
�仯����amol 2amol amol
ƽ������amol 2amol amol
K=c(CH3OH)/[c(CO)��c2(H2)]=a/2��[(a/2��(2a/2)2)=1/a2��
�������������Ͷ��a mol CO��2amol H2��amol CH3OH���൱����������ѹǿ��ƽ�������ƶ�����ԭƽ����ȣ���Ϊ������CO�������������ݻ�δ�䣬����CO��Ũ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м�����ȷ���ǣ� ��
A.�ó���ʯ��ˮ����CO2��SO2
B.��ʪ��ĵ⻯�ص�����ֽ����Br2��g����NO2
C.��CO2����NaAlO2��Һ��NaClO��Һ
D.��Ba��OH��2��Һ����Na2CO3��Һ��NaHCO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܼ��仯�����ڹ�ҵ�����ù㷺����ij��ҵ�������Ʊ������ܵĹ�ҵ������ͼ��
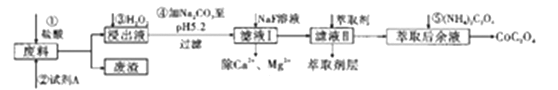
��֪���ٷ�������Ҫ�������������ܡ�������F2O3��Al2O3��MnO��CaO��SiO2�ȣ�
�ڽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�۲���������������������ʽ����ʱ��Һ��pH���±���
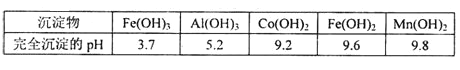
(1)�ڽ��������м���Co2O3�����ᷴӦ�������壬�˷�Ӧ�����ӷ���ʽΪ___________________ ��ʵ�����м��������ķ�����________________��
(2)�����Լ�A��Ŀ����_________________����������Ҫ�ɷ���_______________���ڽ���Һ���ȼ���˫��ˮ��Ӧ���ټ���̼���Ƶ�ԭ����(�������ӷ���ʽ�ͱ�Ҫ�����ּ�������)___________��
(3)��ȡ����Һ�м���(NH4)2C2O4����Co2+���ж�Co2+������ȫ�IJ�����____________________��
(4)��ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ��ʾ������ҺII��������ȡ��pHΪ_____(�����)
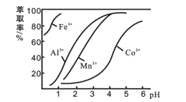
A.�ӽ�2.0 B. �ӽ�3.0 C. �ӽ�5.0
(5)�ڿ����м���CoC2O4���壬���ⶨ��210�桫290��Ĺ�����ֻ����CO2��һ�ֻ�����û���������Ԫ�ص���������Ϊ73.44%���˹��̷�����Ӧ�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3 ���ӵĿռ乹���������Σ��������������ε�ƽ��ṹ��������ʵ�ij��������
A��NH3�����Ǽ��Է���
B��������3��N��H���ļ�����ȣ��������
C��NH3������3��N��H���ļ�����ȣ�3�����Ƕ�����107��
D��NH3������3��N��H���ļ�����ȣ�3�����Ƕ�����120��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���� �� ��
A���ڳ��³�ѹ�£�1 mol Ne���е�ԭ����ΪNA
B����25 �桢1.01��105 Paʱ��11.2 L N2������ԭ����ΪNA
C��18gˮ��������������Ϊ8NA
D����ͬ��ͬѹ�£���ͬ������κ����嵥��������ԭ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��Ϊ������Ԫ�أ�Aԭ��ʧȥһ�����Ӻ��Ϊһ�����ӣ�C��-1������������ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D��C����һ���ڣ�D����ͬ���ڵ�B�γ�BD2�����ӻ����E��CΪͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᡣ�����������Ϣ�ش��������⡣
��1��BԪ����Ԫ�����ڱ��е�λ����____________��
��2������DԪ�ص�ԭ�ӽṹʾ��ͼ____________��
��3��A��E�γɵ��������ĵ���ʽΪ____________��
��4��C���⻯����D���⻯��ķе���Ƚϣ�____________(�û�ѧʽ��ʾ�����ã��������ӣ���
��5��E������������Ӧ��ˮ�����ϡ��Һ��������۷�����Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,����ȷ����( )
A����Ȼ�����Լ���Ϊ��Ҫ�ɷֵĸ�Ч���ȼ��
B��ú�ĸ���ɵõ�ú����,ͨ��ú���͵ķ���ɻ�ø��ַ�����
C��ʯ���к��������ͻ�����,�����ʯ�Ͳ����ܻ�÷�����
D��ͨ��ʯ�͵Ĵ��ѻ����ѽ���Եõ������ͺ���̬ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NOx��CO�ȴ�����Ⱦ��IJ���������������Ҫ���塣
��1��������β��ϵͳ��װ�ô�ת����������Ч����NOx���ŷš�NOx�ڴ�ת�����б�CO��ԭ��N2�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ��________________��
��2��ѡ���Դ���ԭ����(SCR)��Ŀǰ�����������������������ڽ������������£��û�ԭ��(��NH3)ѡ���Ե���NOx��Ӧ����N2��H2O��
����֪��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��H=-905.5kJmol-1
4NO(g)+6H2O(g)��H=-905.5kJmol-1
N2(g)+O2(g)![]() 2NO(g)��H=+180kJmol-1
2NO(g)��H=+180kJmol-1
��ɸ÷�������Ҫ��Ӧ���Ȼ�ѧ����ʽ
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)��H=_________________��
4N2(g)+6H2O(g)��H=_________________��
�ڸ÷���Ӧ���Ʒ�Ӧ�¶���315~400��֮�䣬��Ӧ�¶ȹ��ͻ�Ӱ�췴Ӧ���ʣ����¶�Ҳ���˹��ߣ�ԭ����___________________��
�۰�����[n(NH3)��n(NO)]��ֱ��Ӱ��÷����������ʡ�350��ʱ��ֻ�ı䰱����Ͷ��������Ӧ��x��ת�����백���ȵĹ�ϵ����ͼ��ʾ����X��________________ (�ѧʽ)����n(NH3)��n(NO)��1.0ʱ��������NOŨ�ȷ���������Ҫԭ����________________ ��

��3��ͨ��NOx�������ɼ��NOx�ĺ������乤��ԭ��ʾ��ͼ���£�

��Pt�缫�Ϸ�������______________��Ӧ�����������ԭ������
��д��NiO�缫�ĵ缫��Ӧʽ��___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ�����˵����ȷ����
A. �±�����֬���ױ�����������ʱ������װ�й轺������
B. ���ӽ���Ĥ�ڹ�ҵ��Ӧ�ù㷺�����ȼҵ��ʹ�������ӽ���Ĥ
C. �����ڳ�ʪ�Ŀ����У�������ѧ��ʴ����
D. �������γɵ����ܽ����ж����ЧӦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com