
【题目】NH3 分子的空间构型是三角锥形,而不是正三角形的平面结构,解释该事实的充分理由是
A.NH3分子是极性分子
B.分子内3个N—H键的键长相等,键角相等
C.NH3分子内3个N—H键的键长相等,3个键角都等于107°
D.NH3分子内3个N—H键的键长相等,3个键角都等于120°
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
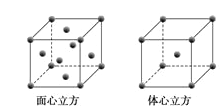
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期主族元素,已知它们的原子序数的关系为X+Z=2Y,且Z的最高价氧化物对应的水化物是强酸。则下列有关说法正确的是
A. 若X是Na,则Z的最高价一定为偶数
B. 若X是O,则YX一定是离子化合物
C. 若Y是O,则非金属性Z>Y>X
D. 若Y是Na,则X、Z不可能是同一主族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学选修5:有机化学基础]
肉桂酸甲酯是一种重要的食用香精,下图朵合成它的反应路线:
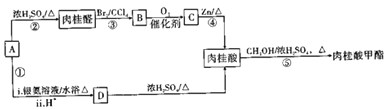
己知:I.芳香族化合物A的分子式为C9H10O2,且只有-个侧链;侧链每个C上最多只有一个官能团;
Ⅱ. lmol A完全催化氧化的产物只能与1molNaOH完全反应
(1) A的结构简式为_______________,肉桂醛的分子式为_______________。
(2)上述合成路线中使用②③步反应的目的是_________________。
(3)第⑤步反应的化学方程式为___________________________。
(4)写出A与银氨溶液反应的化学方程式:_______________________。
(5)D分子中含有多种官能团,不能发生的反应类型有__________(填序号)。
a.酯化反应 b.取代反应 c.加聚反应
d.水解反应 e.消去反应 f.氧化反应
(6) 写出符合下列条件的肉桂醛的同分异构体:_________________(至少3种)。
ⅰ.分子中无甲基
ⅱ.所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的叙述,正确的是
A. 磷脂含有磷元素,脱氧核糖核酸不含氧元素
B. 维生素D属于脂质,能促进肠道对钾和磷的吸收
C. 能与双缩脲试剂产生紫色反应的只有蛋白质
D. 含有DNA和RNA的细胞生物中,DNA是遗传物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯
B.用燃烧法鉴别乙醇、苯和四氯化碳
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上有一种用C02来生产甲醇燃料的方法:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJmol-1
CH3OH(g)+H2O(g) △H=-49.0kJmol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
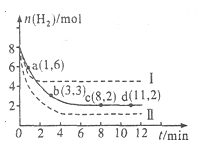
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。
(2)下列时间段平均反应速率最大的是 。
A.O~1 min B.1~3 min C.3~8 min D.8~11 min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线)。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数 (填“增大”“不变”或“减小”)。
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 。
Ⅱ.工业上还可在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是 。
A.2v(H2)(逆)=v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(2)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
【制取氨气】
(1)实验室常用加热氯化铵和氢氧化钙固体混合物的方法来制取氨气,该方法制备氨气的装置为_____(填字母,下同),收集氨气的装置可以是__________。
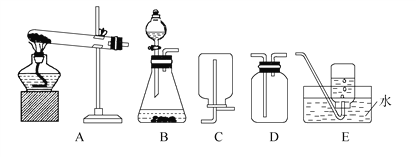
【实验探究】
该小组设计实验探究氨气的还原性及其产物,实验装置图(夹持装置未画出)如下:
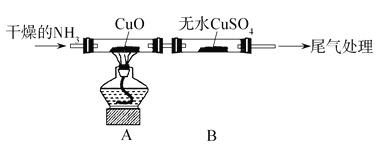
(2)通入的NH3必须干燥的原因是__________________。
(3)实验中观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式:_____________________。
【问题讨论】
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu.请你设计一个简单的实验检验该红色物质中是否含有Cu2O:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com