
【题目】回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbOPbSO4H2O),其实验流程如下: 
(1)物质X可以循环利用,该物质是 . 最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是 .
(2)从滤液A可提取出一种含结晶水的钠盐副产品.若检验该晶体中结晶水的含量,所需的硅酸盐材质仪器有、、、玻璃棒、石棉网、干燥器等.
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4 , 原因可能是 .
(4)生成三盐基硫酸铅的离子反应方程式为 .
(5)向铅膏浆液中加入Na2SO4溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加mL 1.0molL﹣lNa2SO3溶液.
【答案】
(1)HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀
(2)坩埚;酒精灯;泥三角
(3)PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生
(4)4PbSO4+6OH﹣=3PbO?PbSO4?H2O+3SO42﹣+2H2O
(5)30
【解析】解:(1)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3).Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3 , 可循环利用,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42﹣ , 所以答案是:HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀;(2)测量晶体中结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算晶体中结晶水的含量,所以所需的硅酸盐材质仪器有玻璃棒、石棉网、干燥器、坩埚、酒精灯、泥三角,
所以答案是:坩埚;酒精灯;泥三角;(3)生成的硫酸铅难溶于水,覆盖在固体PbO、PbCO3的表面,阻碍反应的进一步发生,所以答案是:PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生;(4)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,反应方程式为:4PbSO4+6NaOH=3PbOPbSO4H2O+3Na2SO4+2H2O,离子方程式为:
4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O,所以答案是:4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O;(5)氧化铅的物质的量为: ![]() =0.03mol,
=0.03mol,
PbO2 ~ | Na2SO3 |
1mol | 1mol |
0.03mol | n |
n=0.03mol,V= ![]() =0.03L=30mL,
=0.03L=30mL,
所以答案是:30.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10﹣10 mol2L﹣2 , Ksp(Ag2CrO4)=1.12×10﹣12 mol3L﹣3 , 下列叙述正确的是( )
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10﹣4molL﹣1的K2CrO4溶液中加入等体积的2.0×10﹣4 molL﹣1 AgNO3溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl﹣的物质的量浓度最大
D.将0.001 molL﹣1的AgNO3溶液逐滴滴入0.001 molL﹣1的KCl和0.001 molL﹣1的K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下  ,下列叙述正确的是( )
,下列叙述正确的是( )
A.有机物A属于芳香烃
B.有机物A和浓硫酸混合加热,可以发生消去反应
C.有机物A中含有两种官能团
D.l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HClO的漂白性,某同学设计如下的实验:
(1)通入氯气后,从集气瓶A中干燥的红色布条的现象可得出的结论是;从集气瓶B中湿润的红色布条的现象可得出的结论是 , 其中氯气发生反应的化学方程式为 .
(2)烧杯中所盛的试剂为 , 其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g 的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4 L 氯气与足量的镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度。请根据下图所示,回答下列问题。
(1)X的化学式是 , 将Na2S2O3填入上图中。
(2)检验Y所用的试剂是 , Y易引起的环境问题是,用NaOH溶液处理含Y的废气,发生反应的离子方程式是。
(3)W的浓溶液与铜反应的化学方程式是。
W的稀溶液与铜不发生反应的原因是。
对比这两个事实可以得出的结论是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 下列说法正确的是( ) 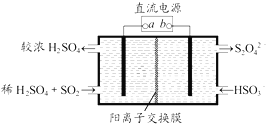
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答相关的问题。
(1)写出④的元素符号。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是(填相应化学式,下同),碱性最强的是。
(4)这些元素中(除⑨外),原子半径最小的是(填元素符号,下同),原子半径最大的是。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com