
【题目】常温下,下列各组离子(或在指定条件下)能大量共存的是( )
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 麦芽糖溶液中:SO42-、MnO4-、K+、H+可以大量共存
D. 0.1mol /LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
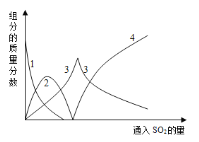
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa, 25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20 mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
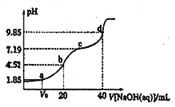
A. a点所得溶液中:c(H2A)>c(HA-) B. b点所得溶液中:c(H2A)+(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-) D. d点所得溶液中A2-水解平衡常数Kh1=10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
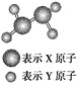
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.高纯硅可用于制作光感电池
B.胃舒平(主要成分:氢氧化铝)可用于胃酸中和剂
C.铝合金大量用于高铁建设
D.生活中常用的玻璃、水泥和陶瓷材料均需用石灰石作工业原料生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
干海带![]() 海带灰
海带灰![]() 水溶液
水溶液![]()
![]()
![]() ―→碘单质
―→碘单质
下列有关叙述正确的是( )
A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. BF3和NH3的空间构型都为平面三角形
B. 晶格能由大到小的顺序:NaF>NaCl>NaBr>NaI
C. 熔点:Na-K合金<氯化钠<钠<金刚石
D. 空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com