
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
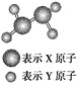
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
【答案】BN2H4N2H4分子之间形成氢键,致使N2H4沸点升高易液化HO![]() 极性
极性![]()
![]() NH4NO3 NH
NH4NO3 NH![]() +OH-
+OH-![]() NH3↑+H2O氧化剂
NH3↑+H2O氧化剂![]()
【解析】
Ⅰ.(1)根据球棍模型可知,该物质的电子式为![]() ,所以X为第ⅤA族元素,Y为第ⅦA族元素,故B错误,答案选B;
,所以X为第ⅤA族元素,Y为第ⅦA族元素,故B错误,答案选B;
(2)由于Y为H元素,所以该物质的分子式为N2H4,N2H4分子之间形成氢键,使N2H4沸点升高易液化,故答案为:N2H4;N2H4分子之间形成氢键,致使N2H4沸点升高易液化;
Ⅱ.(1)根据已知条件可以推断,Z为O,Y为N,W为Na,X为H,故答案为:H、O;
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物是氨气,氨气的电子式为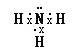 ,氮原子和氢原子之间的共价键是极性键;含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的电子式为
,氮原子和氢原子之间的共价键是极性键;含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的电子式为![]() ;含有极性共价键和非极性共价键的化合物是双氧水或N2H4,其电子式为
;含有极性共价键和非极性共价键的化合物是双氧水或N2H4,其电子式为![]() 或
或![]() 故答案为:
故答案为: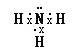 ;极性;
;极性;![]() ;
;![]() 或
或![]() ;
;
(3)NH4NO3是离子化合物,NH4NO3与浓NaOH加热时发生反应:NH![]() +OH-
+OH-![]() NH3↑+H2O;NaH和H2O反应生成NaOH和H2,H2O是氧化剂,故答案为:NH4NO3、NH
NH3↑+H2O;NaH和H2O反应生成NaOH和H2,H2O是氧化剂,故答案为:NH4NO3、NH![]() +OH-
+OH-![]() NH3↑+H2O、氧化剂;
NH3↑+H2O、氧化剂;
(4)钠和氧气反应生成氧化钠,该反应中钠失电子发生氧化反应,氧气得电子发生还原反应,其反应过程为![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)![]() 2NO2(g);ΔΗ<0,不能说明已达到平衡状态的是
2NO2(g);ΔΗ<0,不能说明已达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成O2的速率相等
B. 混合气体颜色深浅保持不变
C. 反应器中压强不随时间变化而变化
D. 混合气体平均分子量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
试回答:
(1)若X是强氧化性气体单质,则A可能是______(填序号)。
a.C b.Al c.Na d.Mg
(2) 若A、B、C均为含有同种金属元素的化合物,且A为氧化物,反应①中X是强碱,反应②中X为CO2,则C的化学式为_________,反应②的离子方程式____________________,反应②中CO2_______(填“能”或“否”)用盐酸或稀硫酸代替.
(3) 若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟。B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)____________________________;检验此C溶液中金属元素的操作方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子(或在指定条件下)能大量共存的是( )
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 麦芽糖溶液中:SO42-、MnO4-、K+、H+可以大量共存
D. 0.1mol /LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图有关图示分析正确的是( )
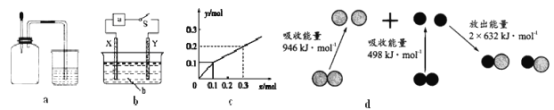
A. 如图a所示,集气瓶内充満Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,焼杯中的水会迸入集气瓶,并可能充满集气瓶
B. 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M
C. Pt内电极, 电解含0.10 mol M+和0.1 molN3+ (M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量変化,则N-N的键能为946kJ·mol-1,其热化学方程式为N2(g)+O2(g)=2NO(g) △H=-180 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)
B. SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构
C. M层电子数为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等
D. 由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:2A(l) ![]() B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
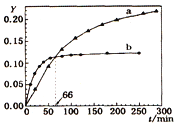
A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com