
【题目】某同学设计如图装置制取少量溴苯,请回答下列问题:
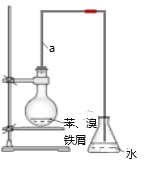
(1)写出实验室制取溴苯的化学方程式___________________。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是_______________你认为这一现象能否说明溴和苯发生了取代反应理由是__________。
(3)该装置中长直导管A的作用_________,锥形瓶中的导管为什么不插入液面下?_______________。
(4)反应后得到的溴苯中溶有少量苯、溴、二溴苯、溴化铁和溴化氢等杂质,将圆底烧瓶内的液体依次进行下列实验操作就可得到较纯净的溴苯。
a.蒸馏水洗涤,振荡,分液;
b.用5%的NaOH溶液洗涤,振荡,分液;
c.用蒸馏水洗涤,振荡,分液;
d.加入无水CaCl2粉末干燥;
e._________________(填操作名称)。
【答案】![]() +Br2
+Br2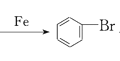 +HBr 浅黄色沉淀 不能,溴易挥发会进入锥形瓶,溴与硝酸银溶液也可发生反应,生成溴化银沉淀 冷凝回流并导气 防止水倒吸入烧瓶中 蒸馏
+HBr 浅黄色沉淀 不能,溴易挥发会进入锥形瓶,溴与硝酸银溶液也可发生反应,生成溴化银沉淀 冷凝回流并导气 防止水倒吸入烧瓶中 蒸馏
【解析】
(1)根据苯和液溴反应生成溴苯和溴化氢解答;
(2)溴化银为淡黄色沉淀;
(3) 苯加热易挥发,需要冷凝回流,该装置中长直导管A的作用是:冷凝回流并导气;停止加热后装置内气压降低,锥形瓶中的导管不插入到液面以下是为了防止水倒吸入烧瓶中;
(4)根据碱的化学性质和除杂的成分解答。
(1)在催化剂的作用下,苯环上的氢原子溴原子所取代,生成溴苯,同时有溴化氢生成:![]() +Br2
+Br2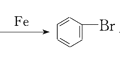 +HBr,故答案为:
+HBr,故答案为:![]() +Br2
+Br2 +HBr;
+HBr;
(2)溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸,因溴单质易挥发,所以进入锥形瓶的有挥发出来的溴单质,溴单质和水反应生成溴化钠和次溴酸钠,所以不能说明溴和苯发生了取代反应,故答案为:浅黄色沉淀;不能;溴易挥发会进入锥形瓶,溴与硝酸银溶液也可发生反应,生成溴化银沉淀;
(3)苯加热易挥发,需要冷凝回流,该装置中长直导管A的作用是:冷凝回流并导气;停止加热后装置内气压降低,锥形瓶中的导管不插入到液面以下是为了防止水倒吸入烧瓶中;
(4)HBr、溴化铁易溶于水而其它物质不易溶于水,所以先水洗洗去氢溴酸和溴化铁;溴和氢氧化钠反应,所以用氢氧化钠洗去溴单质;上一步洗涤会残留部分氢氧化钠,氢氧化钠能溶于水而其它物质不溶于水,所以用水洗去多余的氢氧化钠;用水洗涤后会残留部分水分,所以用干燥剂除去多余的水;利用沸点不同,所以采取蒸馏的方法分离苯与溴苯、二溴苯。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]()
![]() 某温度下,在4L密闭容器中加入纳米级
某温度下,在4L密闭容器中加入纳米级![]() 并通入
并通入![]()
![]() ,记录不同时间产生
,记录不同时间产生![]() 的物质的量如表:
的物质的量如表:
时间 | 20 | 40 | 60 | 80 |
|
|
|
|
|
下列说法正确的是
A.前20min的反应速率![]()
B.达平衡时,至少需要从外界吸收的能量为![]()
C.增大![]() ,可以提高水的分解率
,可以提高水的分解率
D.使用纳米级![]() 颗粒是为了提高催化效果
颗粒是为了提高催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
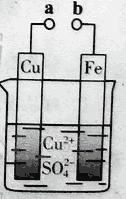
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料。工业上提取铝的工艺流程如下:
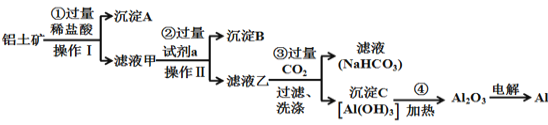
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是:___________________;
(2)沉淀A的化学式是__________;
(3)步骤③中通入过量CO2,产生沉淀C的离子方程式为_________________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为____________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是___________;
a. MgO b. V2O5 c. Fe3O4 d. MnO2
(6)我国首创以铝—空气—海水电池为能源的新型电池,用作海水标志灯已研制成功。该电池以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。负极材料是铝,正极材料可以用石墨。写出正极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:

(1)已知:![]()
![]()
请写出![]() 燃烧热的热化学方程式: ______ .
燃烧热的热化学方程式: ______ .
(2)在不同温度下反应![]() 的平衡常数K如下表:
的平衡常数K如下表:
温度 | 600 | 750 | 900 | 1100 | 1250 |
平衡常数K |
|
| 1 |
|
|
①该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
②900℃时发生上述反应,![]() 的转化率随时间变化如图所示,若到达平衡后加压,则
的转化率随时间变化如图所示,若到达平衡后加压,则![]() 的转化率将
的转化率将![]() 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同![]() ______,正反应速率将 ______. 其他条件相同时,请在图中画出
______,正反应速率将 ______. 其他条件相同时,请在图中画出![]() 时
时![]() 的转化率随时间变化的示意图______.
的转化率随时间变化的示意图______.
③在![]() 时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是
时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是![]() 填编号
填编号![]() ______ ,平衡后与C中各物质的百分含量相等的组有 ______
______ ,平衡后与C中各物质的百分含量相等的组有 ______ ![]() 填编号
填编号![]()
A | B | C | D | E | |
| 3 | 1 | 0 | 1 | 1 |
| 2 | 1 | 0 | 1 | 2 |
| 1 | 2 | 3 |
| 3 |
| 5 | 2 | 3 |
| 1 |
(3)以二甲醚![]() 、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
、空气、KOH溶液为原料可设计为燃料电池放电时,负极电极反应式: _______ .
①假设该燃料电池中盛有![]()
![]() KOH溶液,放电时参与反应的氧气在.
KOH溶液,放电时参与反应的氧气在.
②标准状况下的体积为![]() ,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应X(g)+2Y(g)![]() 3Z(g) ΔH=-a kJ·molˉ1 (a>0),下列说法正确的是 ( )
3Z(g) ΔH=-a kJ·molˉ1 (a>0),下列说法正确的是 ( )
A.容器内气体的压强不再发生变化,说明反应达到平衡状态
B.达到化学平衡状态时,反应放出的总热量可能为 a kJ
C.当反应进行了2min时X的浓度减少了0.1mol/L ,则Z的反应速率为0.15mol·L-1·s-1
D.降低反应温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g) + 3B(g) = 2C(g) + D(g),下列表示反应速率最快的是( )
A. υ(A) =0.5mol·L-1·min-1B. υ(B)=1.2mol·L-1·min-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
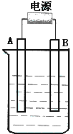
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com