
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
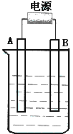
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
【答案】吸氧 2H2O+O2+4e-=4OH- 阴极 4OH--4e-=2H2O+O2↑ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 1 CuO或CuCO3
2Cu+O2↑+4H+ 1 CuO或CuCO3
【解析】
(1)①中性或弱酸性条件下,钢铁发生吸氧腐蚀;
②铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应;
(2)②电解可溶性的铜盐的实质是电解盐和水,根据电极反应书写电解方程式;
③根据电解后所得溶液中氢离子的浓度计算溶液的pH,电解后溶液复原,遵循的原则是:出什么加什么。
(1)①弱酸或中性条件下,钢铁发生吸氧腐蚀,故答案为:吸氧;
②铁、碳和电解质溶液构成原电池,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(2)①电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则一定是氢氧根失电子产生的氧气,电极方程式为4OH--4e-=2H2O+O2↑;
②阴极反应:2Cu2++4e-=2Cu,阳极反应:4OH--4e-=2H2O+O2↑,电解时反应的总离子方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以生成氢离子的物质的量为0.05mol,所以![]() ,则pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3。
,则pH=1,电解后析出了金属铜和有氧气放出,所以要想溶液复原,需加入 CuO或CuCO3。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如图装置制取少量溴苯,请回答下列问题:
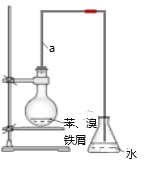
(1)写出实验室制取溴苯的化学方程式___________________。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是_______________你认为这一现象能否说明溴和苯发生了取代反应理由是__________。
(3)该装置中长直导管A的作用_________,锥形瓶中的导管为什么不插入液面下?_______________。
(4)反应后得到的溴苯中溶有少量苯、溴、二溴苯、溴化铁和溴化氢等杂质,将圆底烧瓶内的液体依次进行下列实验操作就可得到较纯净的溴苯。
a.蒸馏水洗涤,振荡,分液;
b.用5%的NaOH溶液洗涤,振荡,分液;
c.用蒸馏水洗涤,振荡,分液;
d.加入无水CaCl2粉末干燥;
e._________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2NO2(g)![]() N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是
N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是

图a 图b
A. 图a 中,A1→A2变化的原因一定是充入了NO2
B. 图b中,E点对应状态中,v(正)> v(逆)
C. 图b中,E→A所需的时间为x,D→C所需时间为y,则x < y
D. 依据图b分析可知,该化学反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D.c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
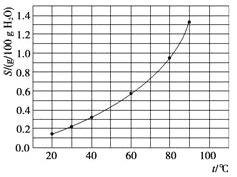
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取浓度均为0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。将浓度均为0.1mol/L、体积均为1L的HA溶液和HB溶液分别加水稀释至体积为VL,溶液pH的变化曲线如图所示,则下列说法正确的是

A.HA是强酸,HB是弱酸
B.X是HB,Y是HA
C.常温下,pH相等的NaA溶液与NaB溶液的物质的量浓度:c(NaA)<c(NaB)
D.NaA与NaB的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(HA)+c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是

A. HR 的电离常数Ka=5×10-6
B. 图中X<7
C. a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D. b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中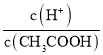 值增大的措施是_____
值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
(3)常温下,有等pH的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa,三种溶液浓度由大到小的顺序为:_______________(填序号)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时,
时,![]() 、HCN和
、HCN和![]() 的电离常数如表:
的电离常数如表:
| HCN |
|
|
|
|
下列有关叙述错误的是![]()
A.向NaCN溶液中通入少量![]() 的离子方程式:
的离子方程式:![]()
B.![]() 时,反应
时,反应![]() 的化学平衡常数为
的化学平衡常数为![]()
C.中和等体积、等物质的量浓度的![]() 和HCN溶液,消耗NaOH的量前者小于后者
和HCN溶液,消耗NaOH的量前者小于后者
D.等物质的量浓度的![]() 和NaCN混合溶液中:
和NaCN混合溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com