
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中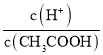 值增大的措施是_____
值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
(3)常温下,有等pH的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa,三种溶液浓度由大到小的顺序为:_______________(填序号)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
【答案】AD 14 c>a>b b>a>d>c 9×10-10
【解析】
1)要使溶液中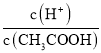 值增大,应是平衡向电离的方向移动;
值增大,应是平衡向电离的方向移动;
(2)该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,应存在n(H+)=n(OH-);
(3)酸性越强,水解程度越弱;
(4)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化,依据溶度积分别计算;100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,根据氯化银的Ksp=1.8×10-10计算.
:(1)A.加水稀释,pH正向移动,溶液中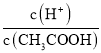 值增大,故A正确;
值增大,故A正确;
B.加入少量CH3COONa固体,醋酸根离子浓度增大,抑制醋酸的电离,则溶液中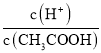 值减小,故B错误;
值减小,故B错误;
C.加入少量冰醋酸,醋酸浓度增大,平衡逆向移动,则溶液中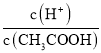 值减小,故C错误;
值减小,故C错误;
D.通入少量HCl气体,氢离子浓度增大,则溶液中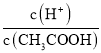 值增大,故D正确;
值增大,故D正确;
故答案为:AD;
(2)该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则100×10-a=1×10b-12,则2-a=b-12,a+b=14,故答案为:14;
(3)已知酸性醋酸>碳酸>次氯酸,则酸越强,对应的钠盐的pH越小,若pH相同则浓度c>a>b,故答案为:c>a>b;
(4)100mL 0.2molL-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,c100mL 0.1molL-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;d100mL 0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为b>a>d>c,100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加如氯化银后,氯离子浓度为1.8×1010/0.2=9×10-10mol/L,故答案为:b>a>d>c;9×10-10.


科目:高中化学 来源: 题型:
【题目】对于反应2A(g) + 3B(g) = 2C(g) + D(g),下列表示反应速率最快的是( )
A. υ(A) =0.5mol·L-1·min-1B. υ(B)=1.2mol·L-1·min-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
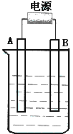
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法不正确的是( )
A.煤的气化、液化、干馏和石油的裂化、裂解、催化重整都是化学变化
B.向污水中投放明矾,利用生成的胶体净水:![]()
![]() 胶体
胶体![]()
C.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列从海洋中获取物质的方案不合理的是
A.粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后和石灰乳反应制得漂白粉
B.苦卤酸化后通入氯气得到溴水,然后用热空气将其通入到SO2水溶液中,最后通入氯气后蒸馏得粗溴
C.干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质
D.向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
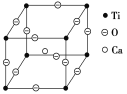
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com