
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
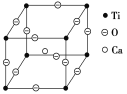
【答案】Mg 相反 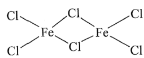 4 分子晶体 苯胺分子之间存在氢键 O SP3 CaTiO3
4 分子晶体 苯胺分子之间存在氢键 O SP3 CaTiO3 ![]() g/cm3
g/cm3
【解析】
该选修题涉及到了元素周期表和对角线原则、核外电子排布式的写法、配位物的形成,以及熔沸点的判断方式和分子晶体的判断方法。电负性的判断和杂化轨道的计算。
(1)根据元素周期表和对角线原则可知与Li化学性质相似的是Mg,Mg的最外层电子数是2,占据s轨道,s轨道最多容纳2个电子,所以自旋方向相反;
(2)氯化铁的双聚体,就是两个氯化铁相连接在一 起,已知氯化铁的化学键有明显的共价性所以仿照共价键的形式将两个氯化铁连接在一起, 即结构式为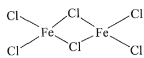 ,因此Fe的配位数为4;
,因此Fe的配位数为4;
(3)大多数有机物都是分子晶体,除了一部分有机酸盐和有机碱盐是离子晶体。苯胺比甲苯的熔沸点都高,同一种晶体类型熔沸点不同首先要考虑的就是是否有氢键,苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高;
(4)电负性与非金属性的大小规律相似,从左到右依次增大,O就是最大的;
PO43-中价层电子对个数=4+![]() (5-5)=4,含孤电子对数为0,杂化轨道数4,所以原子杂化方式是sp3杂化;
(5-5)=4,含孤电子对数为0,杂化轨道数4,所以原子杂化方式是sp3杂化;
(5) )利用均摊法可以知道在每个晶胞中钛离子个数为8![]() =1,氧离子的个数为12
=1,氧离子的个数为12![]() ,钙离子个数为1,所以氧、钛、钙的离子个数比是3:1:1,化学式可表示为CaTiO3;
,钙离子个数为1,所以氧、钛、钙的离子个数比是3:1:1,化学式可表示为CaTiO3;
因为在每个晶胞中含有一个CaTiO3,根据![]() 可以知道密度为
可以知道密度为![]() =
= ![]() g/cm3。
g/cm3。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D.c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中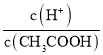 值增大的措施是_____
值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
(3)常温下,有等pH的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa,三种溶液浓度由大到小的顺序为:_______________(填序号)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠
B. 乙酸的分子模型可表示为![]()
C. 石油分馏是物理变化,可得到汽油、煤油和柴油等产品
D. 相同物质的量的C3H6和C3H8O,充分燃烧,消耗氧气量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g) +![]() O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
A. H2的燃烧热为285.8 kJ/mol
B. 2H2(g) + O2(g)2H2O(l) ΔH = -571.6 kJ/mol
C. 1 mol H2完全燃烧生成气态水放出的热量大于285.8 kJ
D. 形成1 mol H2O的化学键释放的总能量大于断裂1 mol H2和0.5 mol O2 的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应
①![]()
②稀溶液中,![]() ,
,
下列结论正确的是![]()
A.碳的燃烧热为![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 浓
浓![]() 与1molNaOH溶液混合,产生
与1molNaOH溶液混合,产生![]() 热量
热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出![]() 热量
热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时,
时,![]() 、HCN和
、HCN和![]() 的电离常数如表:
的电离常数如表:
| HCN |
|
|
|
|
下列有关叙述错误的是![]()
A.向NaCN溶液中通入少量![]() 的离子方程式:
的离子方程式:![]()
B.![]() 时,反应
时,反应![]() 的化学平衡常数为
的化学平衡常数为![]()
C.中和等体积、等物质的量浓度的![]() 和HCN溶液,消耗NaOH的量前者小于后者
和HCN溶液,消耗NaOH的量前者小于后者
D.等物质的量浓度的![]() 和NaCN混合溶液中:
和NaCN混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
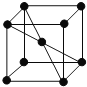
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
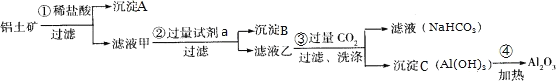
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:
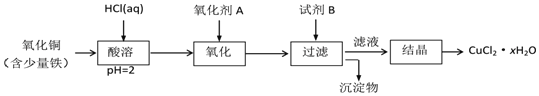
已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com