
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
【答案】N sp ![]()
![]()
![]()
![]() 5:2 体心立方密堆积 8
5:2 体心立方密堆积 8 ![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电
是离子化合物,熔融能导电
【解析】
A为周期表中原子半径最小的元素,则A为H元素;B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道,C只能处于VA族,故C为N元素,D为O元素;结合问题(3)中为
,且C无空轨道,C只能处于VA族,故C为N元素,D为O元素;结合问题(3)中为![]() ,B的化合价为
,B的化合价为![]() ,故B为碳元素;F为短周期金属元素,其单质既可以与酸又可以与碱反应放出
,故B为碳元素;F为短周期金属元素,其单质既可以与酸又可以与碱反应放出![]() ,则F为Al;E与A同主族,与F、G同周期,即处于第三周期,故E为Na;G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍,核外电子排布为
,则F为Al;E与A同主族,与F、G同周期,即处于第三周期,故E为Na;G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍,核外电子排布为![]() ,故G为Cl,据此解答。
,故G为Cl,据此解答。
(1)N2O与![]() 分子是等电子体,二氧化碳和N2O分子具有相似的结构,且
分子是等电子体,二氧化碳和N2O分子具有相似的结构,且![]() 分子中氧原子只与一个氮原子相连,所以N2O的电子式为:
分子中氧原子只与一个氮原子相连,所以N2O的电子式为:![]() ,
,![]() 分子中的中心原子是N;
分子中的中心原子是N;![]() 离子中C原子之间形成碳碳三键,每个C原子有1对孤对电子,故C原子杂化轨道数目为2,采取sp杂化,故答案为:N;sp;
离子中C原子之间形成碳碳三键,每个C原子有1对孤对电子,故C原子杂化轨道数目为2,采取sp杂化,故答案为:N;sp;
(2)![]() 的电子式是
的电子式是![]() ,它与
,它与![]() 按物质的量之比为1:1混合后投入水中,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与氧化铝反应生成偏铝酸钠与水,得到氢氧化钠与氧化铝恰好反应,所发生反应的化学方程式为:
按物质的量之比为1:1混合后投入水中,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与氧化铝反应生成偏铝酸钠与水,得到氢氧化钠与氧化铝恰好反应,所发生反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)![]() 溶液中,
溶液中,![]() 的水解程度大于电离程度,溶液呈碱性,溶液中氢离子源于水的电离及
的水解程度大于电离程度,溶液呈碱性,溶液中氢离子源于水的电离及![]() 的电离,故溶液中阴阳离子浓度由大到小的关系式是:
的电离,故溶液中阴阳离子浓度由大到小的关系式是:![]() ,若用Al单质为电极材料,电解
,若用Al单质为电极材料,电解![]() 溶液,阳极发生氧化反应,Al放电得到
溶液,阳极发生氧化反应,Al放电得到![]() ,
,![]() 与溶液中
与溶液中![]() 发生水解反应生成
发生水解反应生成![]() 、
、![]() ,则阳极的发生的电极反应式为:
,则阳极的发生的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)一定量的![]() 、
、![]() 、NO混合气体投入水中恰好被完全吸收,发生化合反应生成
、NO混合气体投入水中恰好被完全吸收,发生化合反应生成![]() ,H原子来源于水,
,H原子来源于水,![]() 可以改写为
可以改写为![]() ·
·![]() ,则混合气体中N、O原子的个数比为1:
,则混合气体中N、O原子的个数比为1:![]() :2,故答案为:5:2;
:2,故答案为:5:2;
(5)钠单质的晶胞如图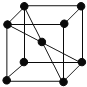 ,其堆积模型是体心立方密堆积,配位数是8,故答案为:体心立方密堆积;8;
,其堆积模型是体心立方密堆积,配位数是8,故答案为:体心立方密堆积;8;
(6)![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电,因此常用
是离子化合物,熔融能导电,因此常用![]() 为原料而不用
为原料而不用![]() 作原料,故答案为:
作原料,故答案为:![]() 是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而
是共价化合物,属于分子晶体,加热会升华,熔融不导电,不能用于电解,而![]() 是离子化合物,熔融能导电。
是离子化合物,熔融能导电。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
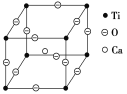
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀,![]() 时,AgI饱和溶液中
时,AgI饱和溶液中![]() 为
为![]() ,AgCl饱和溶液中
,AgCl饱和溶液中![]() 为
为![]() 。若在5mL含有KCl和KI浓度均为
。若在5mL含有KCl和KI浓度均为![]() 的混合溶液中,滴加8mL
的混合溶液中,滴加8mL![]() 的
的![]() 溶液,则下列叙述中不正确的是
溶液,则下列叙述中不正确的是
A.溶液中所含溶质的离子浓度大小关系为:![]()
B.溶液中先产生的是AgI沉淀
C.AgCl的![]() 的数值为
的数值为![]()
D.在AgI悬浊液中滴加KCl溶液,可能使黄色沉淀转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
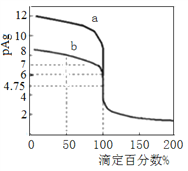
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com