
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
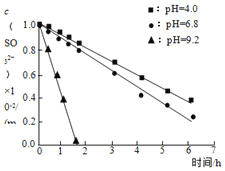
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是

A. HR 的电离常数Ka=5×10-6
B. 图中X<7
C. a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D. b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g) +![]() O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
O2(g)H2O(l)ΔH = -285.8 kJ/mol。下列说法不正确的是
A. H2的燃烧热为285.8 kJ/mol
B. 2H2(g) + O2(g)2H2O(l) ΔH = -571.6 kJ/mol
C. 1 mol H2完全燃烧生成气态水放出的热量大于285.8 kJ
D. 形成1 mol H2O的化学键释放的总能量大于断裂1 mol H2和0.5 mol O2 的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时,
时,![]() 、HCN和
、HCN和![]() 的电离常数如表:
的电离常数如表:
| HCN |
|
|
|
|
下列有关叙述错误的是![]()
A.向NaCN溶液中通入少量![]() 的离子方程式:
的离子方程式:![]()
B.![]() 时,反应
时,反应![]() 的化学平衡常数为
的化学平衡常数为![]()
C.中和等体积、等物质的量浓度的![]() 和HCN溶液,消耗NaOH的量前者小于后者
和HCN溶液,消耗NaOH的量前者小于后者
D.等物质的量浓度的![]() 和NaCN混合溶液中:
和NaCN混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(3)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(4)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(5)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(6)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
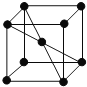
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )
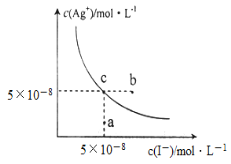
A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com