
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(3)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(4)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(5)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(6)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
【答案】2NaCl+2H2O ![]() Cl2↑+2NaOH+H2↑ c(Na+) >c(CO32-) >c(OH-) >c(HCO3-) >c(H+) Al3++3HCO3--=Al(OH)3↓+3CO2↑ 10:1 1×10-3mol/L 3
Cl2↑+2NaOH+H2↑ c(Na+) >c(CO32-) >c(OH-) >c(HCO3-) >c(H+) Al3++3HCO3--=Al(OH)3↓+3CO2↑ 10:1 1×10-3mol/L 3
【解析】
(1)电解氯化钠溶液的化学方程式:![]() ;
;
(2)Na2CO3溶液中CO32-水解呈碱性,以此判断溶液中离子浓度大小;
(3)Al2(SO4)3 溶液和小苏打(NaHCO3)发生双水解反应;
(4)通过氢离子浓度和氢氧根浓度和水的离子积常数计算体积比;
(5)NH4Cl 溶液中水电离出的 c(H+)等于溶液中氢离子浓度;
(6)通过KSP计算OH-浓度,再利用水的离子积常数计算H+浓度。
(1)电解氯化钠溶液的化学方程式:![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na2CO3溶液中存在:![]() ;则
;则![]() ,故答案为:
,故答案为:![]() ;
;
(3)Al2(SO4)3 溶液和 (NaHCO3)发生双水解反应生成氢氧化铝和二氧化碳,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)25℃时,![]() ,则pH=12 的 Ba(OH)2溶液c(OH-)=0.01mol·L-1, pH=1的HCl溶液c(H+)=0.1mol·L-1,若所得混合液为中性,则a×c(OH-)=b×c(H+),解得a:b=10:1;
,则pH=12 的 Ba(OH)2溶液c(OH-)=0.01mol·L-1, pH=1的HCl溶液c(H+)=0.1mol·L-1,若所得混合液为中性,则a×c(OH-)=b×c(H+),解得a:b=10:1;
故答案为:10:1;
(5)NH4Cl 溶液中水电离出的 c(H+)等于溶液中氢离子浓度)pH=3,则c(H+)=10-3mol·L-1;
故答案为:1×10-3mol/L;
(6)常温时,Fe(OH)3 的溶度积常数KSP=c3(OH-)×c(Fe3+)=1×10-38, c(Fe3+)<10-5 mol·L-1,则c3(OH-)> ![]() =
=![]() =10-33,所以c(OH-)>10-11mol/L,所以pH应大于3;
=10-33,所以c(OH-)>10-11mol/L,所以pH应大于3;
故答案为:3。


科目:高中化学 来源: 题型:
【题目】已知HCN、CN-在溶液中存在下列平衡及其对应的平衡常数:①HCN![]() H++ CN- △H 1>0,K1 ②CN-+H2O
H++ CN- △H 1>0,K1 ②CN-+H2O ![]() HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
A. 混合溶液的pH<7
B. 对混合溶液进行微热,K1 增大、K2 减小
C. K2≈ 1.6×10-5
D. c(Na+) = c(HCN) + c(CN—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图叙述正确的是![]()

A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
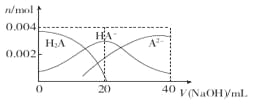
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
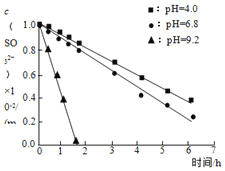
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
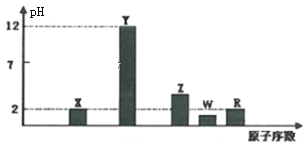
(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
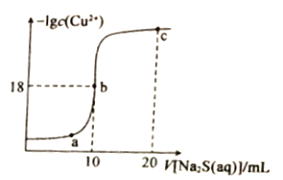
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com