
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
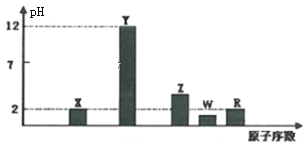
(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
【答案】第三周期ⅦA族  离子键、共价键(或非极性共价键) AC 32 Pb(OH)4>Sn(OH)4>Ge(OH)4
离子键、共价键(或非极性共价键) AC 32 Pb(OH)4>Sn(OH)4>Ge(OH)4 ![]()
【解析】
I.X、Y、Z、W、R的原子序数依次增大,最高价氧化物对应水化物溶液浓度均为0.01molL-1,Y的pH为12,为一元强碱,则Y是Na元素,X、R的pH均为2,为一元强酸,则X为N元素、R为Cl元素;W的pH小于2,则为二元强酸,故W为S元素;Z的pH大于2,为弱酸,则Z为P元素;据此分析解答;
Ⅱ.(1)根据元素非金属性强弱的判断方法分析判断;
(2)①Ge处于第四周期第IVA族,同主族相邻元素原子序数相差第四周期容纳元素的种数,据此分析计算;②金属性越强,最高价氧化物对应水化物的碱性越强,据此排序;
(3)COS与CO2相似,则COS中C原子分别与O原子、S原子之间形成2对共用电子对。
I.根据上述分析,X为N元素,Y是Na元素,Z为P元素,W为S元素,R为Cl元素。
(1)元素R为Cl,在周期表中位于第三周期ⅦA族。元素Z为P元素,原子结构示意图为: ,故答案为:第三周期ⅦA族;
,故答案为:第三周期ⅦA族; ;
;
(2)元素Y和W形成的Y2W2型化合物为Na2S2,其中含有的化学键类型为:离子键和共价键,故答案为:离子键、共价键(或非极性共价键);
Ⅱ.(1)A.S与H2发生化合反应比C与H2化合更容易,说明S的非金属性更强,故A正确;B.H2SO3不是S的最高价含氧酸,不能根据酸性:H2SO3 >H2CO3判断中心元素C和S的非金属性强弱,故B错误;C.CS2中碳元素为+4价,硫元素为-2价,说明S元素对键合电子吸引能力更强,则S的非金属性更强,故C正确;故答案为:AC;
(2)①Ge处于第四周期第IVA族,同主族相邻元素原子序数相差第四周期容纳元素的种数,故Ge的原子序数为14+18=32,故答案为:32;
②金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Pb(OH)4>Sn(OH)4>Ge(OH)4,故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4;
(3)COS与CO2相似,则COS中C原子分别与O原子、S原子之间形成2对共用电子对,羰基硫(COS)的电子式为![]() ,故答案为:
,故答案为:![]() 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】研究![]() 的利用对促进低碳社会的构建具有重要的意义。
的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将![]() 和
和![]() 转化为甲醇蒸气和水蒸气的相关反应有:
转化为甲醇蒸气和水蒸气的相关反应有:
![]()
![]()
则由甲醇蒸气和水蒸气转化为![]() 和
和![]() 的热化学方程式为______。
的热化学方程式为______。
(2)在一定温度下,向2L固定容积的密闭容器中通入![]() 、
、![]() ,发生反应
,发生反应![]() 。测得
。测得![]() 和
和![]() 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:

①能说明该反应已达平衡状态的是______。
A.单位时间内有![]() 键断裂,同时又有
键断裂,同时又有![]() 键断裂
键断裂
B.混合气体的平均相对分子质量不随时间变化
C.混合气体的密度不随时间变化
D.体系中 =1:1,且保持不变
=1:1,且保持不变
②下列措施能使![]() 增大的是______。
增大的是______。
A.升高温度![]()
![]() 恒温恒容下,再充入
恒温恒容下,再充入![]() 、
、![]()
C.使用高效催化剂
![]() 恒温恒容充入
恒温恒容充入![]() 使体系压强增大
使体系压强增大
③已知该温度下此反应的平衡常数![]() ,若使K的值变为1,应采取的措施是_____。
,若使K的值变为1,应采取的措施是_____。
A.升高温度![]() 降低温度
降低温度![]() 增大压强
增大压强![]() 恒压加入一定量
恒压加入一定量![]()
(3)捕捉![]() 可以利用
可以利用![]() 溶液。用
溶液。用![]() 溶液完全捕捉
溶液完全捕捉![]() 气体
气体![]() 溶液体积不变
溶液体积不变![]() ,所得溶液中
,所得溶液中![]() ______
______![]()
(4)用![]() 和天然气可以制备CO和
和天然气可以制备CO和![]() ,
,![]() 。密闭容器中浓度均为
。密闭容器中浓度均为![]() 的
的![]() 与
与![]() ,在一定条件下反应,测得
,在一定条件下反应,测得![]() 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。若
。若![]() ,则
,则![]() 时该反应的平衡常数
时该反应的平衡常数![]() ______
______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(3)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(4)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(5)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(6)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.某价电子排布为3d14s2 的 基态原子,该元素位于周期表中第四周期第ⅢB族
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C.某基态原子的核外电子排布图为![]() , 它违背了泡利原理
, 它违背了泡利原理
D.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
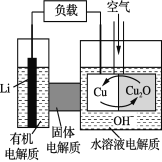
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 molL-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 molL-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 molL-1盐酸、③0.1 molL-1氯化镁溶液、④0.1 molL-1硝酸银溶液中,Ag+浓度:④>①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com