
【题目】已知H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关,下列说法不正确的是![]()
![]()
A.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
B.向污水中投放明矾,利用生成的胶体净水:![]() 胶体
胶体![]()
C.煤的气化、液化、干馏和石油的裂化、裂解、催化重整都是化学变化
D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图叙述正确的是![]()

A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图:


回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2OSO3H)的有机反应类型是____,转化④的化学方程式是_____。
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为_________,转化⑤的化学方程式为____________。
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。该反应的化学方程式为_____。
(4)已知:CH3CHO+NaHSO3→![]() ↓(α﹣羟基乙磺酸钠),所得乙醛可用如图方式提纯:
↓(α﹣羟基乙磺酸钠),所得乙醛可用如图方式提纯:

①乙醛晶体类型为__________。
②分离操作A的名称是____;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”),下列有关操作与装置的分析,正确的是_____(填字母,多选反扣)。

A.烧杯中应装冰水
B.冷凝管应通温水
C.如图示装置可用于除去乙酸乙酯中混有的乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1二元酸H2A溶液中滴加0.2 mol·L-l NaOH溶液,有关微粒物质的量变化如图。下列叙述正确的是( )
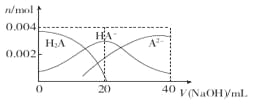
A. 当V(NaOH)="20" mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c( A2-)>c( OH-)> ((H+)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中的大
C. 等浓度H2A和NaHA的混合溶液中无论加入少量的强酸或强碱,溶液的pH变化都不大
D. 当V(NaOH) ="40" mL时,升高温度,c(Na+)/c(A2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
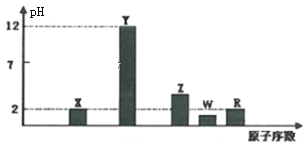
(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
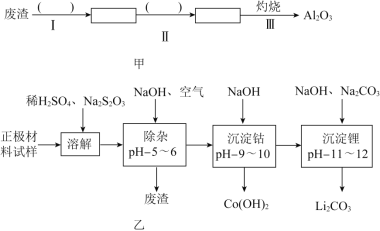
【题目】废旧锂离子电池的正极材料试样![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通过下列实验方法回收钴、锂.
可通过下列实验方法回收钴、锂.
(1)在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的离子方程式为 ______ .
在溶解过程中反应的离子方程式为 ______ .
沉淀物 | 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除杂时通入空气的目的 ______ ,所得的废渣成分为 ______ ![]() 从废渣中获得
从废渣中获得![]() 的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
(3)工业上,将![]() 粗品制备成高纯
粗品制备成高纯![]() 的部分工艺如图乙.
的部分工艺如图乙.
![]() 将
将![]() 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
![]() 电解后向LiOH溶液中加入过量
电解后向LiOH溶液中加入过量![]() 溶液,过滤、烘干得高纯
溶液,过滤、烘干得高纯![]() .
.
①![]() 中,阴极的电极反应式是 ______ .
中,阴极的电极反应式是 ______ .
②![]() 中,生成
中,生成![]() 反应的化学方程式是 ______ .
反应的化学方程式是 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com