
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比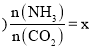 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
【答案】![]()
![]() 增大,平衡正向移动,
增大,平衡正向移动,![]() 转化率增大
转化率增大 ![]() 不变 13 醋酸溶液中存在电离平衡:
不变 13 醋酸溶液中存在电离平衡:![]() ,当加入
,当加入![]() 固体时,
固体时,![]() 浓度增大,使CH3COOH电离平衡逆向移动,
浓度增大,使CH3COOH电离平衡逆向移动,![]() 浓度降低,故pH增大
浓度降低,故pH增大 ![]() FeS PbS
FeS PbS
【解析】
Ⅰ.①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;依据x含义和图象数据分析结合化学方程式换算氨气转化率;
③恒温恒容条件下,充入稀有气体,反应体系中各组分的浓度不变,平衡不移动;
Ⅱ.(1)纯水电离生成的![]() ,
,![]() ,先计算出过量的
,先计算出过量的![]() ,再结合Kw计算
,再结合Kw计算![]() ,得出反应后的溶液的pH;
,得出反应后的溶液的pH;
(2)存在![]() 电离平衡,氢离子浓度减小则pH增大;该混合溶液中
电离平衡,氢离子浓度减小则pH增大;该混合溶液中![]() ,则水解小于电离;
,则水解小于电离;
Ⅲ.(1)根据图2判断出![]() 、
、![]() 、
、![]() 的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
(2)根据![]() 、
、![]() 、
、![]() 的溶解度大小及难溶物溶解平衡判断沉淀转化情况。
的溶解度大小及难溶物溶解平衡判断沉淀转化情况。
Ⅰ:①平衡常数随温度升高减小,说明正反应为放热反应,![]() ,故答案为:
,故答案为:![]() ;
;
②![]() ,图象分析判断,增大氨气浓度平衡正向进行;B点处
,图象分析判断,增大氨气浓度平衡正向进行;B点处![]() ,原料气中的
,原料气中的![]() 和
和![]() 的物质的量之比为4,二氧化碳转化率为
的物质的量之比为4,二氧化碳转化率为![]() ,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为
,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为![]() ,依据化学方程式
,依据化学方程式![]() 反应消耗的氨气为1mol,反应后气体总物质的量为:
反应消耗的氨气为1mol,反应后气体总物质的量为:![]() ,B点时
,B点时![]() 的体积分数为:
的体积分数为:![]() ,故答案为:
,故答案为:![]() 增大,平衡正向移动,
增大,平衡正向移动,![]() 转化率增大;
转化率增大;![]() ;
;
③达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,![]() 的质量不变,故答案为:不变;
的质量不变,故答案为:不变;
Ⅱ.(1)纯水电离生成的![]() ,
,![]() ,过量的
,过量的![]() ,由该温度下的Kw可知,
,由该温度下的Kw可知,![]() ,所以
,所以![]() ,故答案为:13;
,故答案为:13;
(2)存在![]() 电离平衡,加入
电离平衡,加入![]() 固体,
固体,![]() 增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;该混合溶液中
增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;该混合溶液中![]() ,则醋酸根离子的水解程度小于其电离程度,所以
,则醋酸根离子的水解程度小于其电离程度,所以![]() ,
,
故答案为:醋酸溶液中存在电离平衡:![]() ,当加入
,当加入![]() 固体时,
固体时,![]() 浓度增大,使CH3COOH电离平衡逆向移动,
浓度增大,使CH3COOH电离平衡逆向移动,![]() 浓度降低,故pH增大;
浓度降低,故pH增大;![]() ;
;
Ⅲ.(1)根据图2可知,![]() 、
、![]() 、
、![]() 的溶度积大小关系为:
的溶度积大小关系为:![]() ,则溶解度
,则溶解度![]() ,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,故答案为:FeS;
,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,故答案为:FeS;
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、![]() 的溶液,由于
的溶液,由于![]() ,溶解度
,溶解度![]() ,则振荡后,ZnS沉淀会转化为更难溶的PbS,故答案为:PbS。
,则振荡后,ZnS沉淀会转化为更难溶的PbS,故答案为:PbS。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为测定某![]() 溶液的浓度,取
溶液的浓度,取![]() 该溶液于锥形瓶中,加入适量稀
该溶液于锥形瓶中,加入适量稀![]() 后,用浓度为c
后,用浓度为c![]()
![]() 标准溶液滴定。
标准溶液滴定。
(1)其反应的离子方程式为______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
(2)滴定时,![]() 溶液应装在______
溶液应装在______![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() 中,达到滴定终点的现象为______
中,达到滴定终点的现象为______
(3)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度______![]() 填“偏高”“偏低”“无影响”
填“偏高”“偏低”“无影响”![]()
(4)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为______![]()
(5)在该溶液与KOH溶液反应所得的![]()
![]() 溶液中,
溶液中,![]() ,下列关系正确的是______
,下列关系正确的是______
A.![]()
B.![]()
![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应
①![]()
②稀溶液中,![]() ,
,
下列结论正确的是![]()
A.碳的燃烧热为![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 浓
浓![]() 与1molNaOH溶液混合,产生
与1molNaOH溶液混合,产生![]() 热量
热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出![]() 热量
热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.

(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为_______,该物质的分子式是_______.
(3)根据有机化合物的成键特点,预测A的可能结构并写出结构简式__________.
II.结构式的确定:
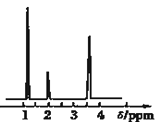
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.经测定,有机物A的核磁共振氢谱示意图如图②,则A的结构简式为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
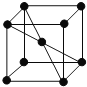
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中金属腐蚀难以避免。对图a和图b的分析合理的是
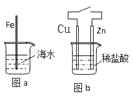
A.图a,负极上发生的反应是:O2+4e+2H2O → 4OH-
B.图b,接通开关后溶液中的H+向正极移动
C.图a,插入海水中的铁棒,越靠近底端腐蚀越严重
D.图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com