
【题目】为测定某![]() 溶液的浓度,取
溶液的浓度,取![]() 该溶液于锥形瓶中,加入适量稀
该溶液于锥形瓶中,加入适量稀![]() 后,用浓度为c
后,用浓度为c![]()
![]() 标准溶液滴定。
标准溶液滴定。
(1)其反应的离子方程式为______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
(2)滴定时,![]() 溶液应装在______
溶液应装在______![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() 中,达到滴定终点的现象为______
中,达到滴定终点的现象为______
(3)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度______![]() 填“偏高”“偏低”“无影响”
填“偏高”“偏低”“无影响”![]()
(4)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为______![]()
(5)在该溶液与KOH溶液反应所得的![]()
![]() 溶液中,
溶液中,![]() ,下列关系正确的是______
,下列关系正确的是______
A.![]()
B.![]()
![]()
C.![]()
D.![]()
【答案】2 5 6 2 ![]() 酸式滴定管 滴入一滴
酸式滴定管 滴入一滴![]() 溶液变成紫色
溶液变成紫色![]() 或红色
或红色![]() 且半分钟不褪色
且半分钟不褪色 ![]()
![]() BD
BD
【解析】
(1)草酸被酸性高锰酸钾氧化生成二氧化碳,据氧化还原反应中电子守恒、原子守恒和电荷守恒配平;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去;
(3)根据所用过程判断不当操作对相关物理量的影响;
(4)注意参加反应的高锰酸钾与草酸的物质的量之比为2:5,据c(待测)=![]() ×
×![]() 求算;
求算;
(5)在KHC2O4溶液中c(C2O42-)>c(H2C2O4),说明HC2O4-的电离程度大于其水解程度,溶液显酸性,结合电荷守恒、物料守恒分析。
(1)草酸被酸性高锰酸钾氧化生成二氧化碳,1mol草酸反应转移2mol电子,1mol高锰酸钾反应转移5mol电子,其物质的量之比为5:2,再据原子守恒和电荷守恒配平的离子方程式为:![]() ;
;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,草酸与酸性高锰酸钾发生氧化还原反应,当滴定到终点时,二者恰好完全反应,再滴入一滴![]() 溶液变成紫色
溶液变成紫色![]() 或红色
或红色![]() 且半分钟不褪色,可说明达到滴定终点;
且半分钟不褪色,可说明达到滴定终点;
(3)盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致![]() 浓度偏小,
浓度偏小,![]() 标准
标准![]() 偏大,据
偏大,据![]() 待测
待测 可知,
可知,![]() 待测
待测![]() 偏高;
偏高;
(4)注意参加反应的高锰酸钾与草酸的物质的量之比为2:5,![]() 待测
待测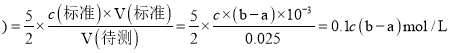 ;
;
(5在![]() 溶液中,
溶液中,![]() ,说明
,说明![]() 的电离程度大于其水解程度,溶液显酸性。
的电离程度大于其水解程度,溶液显酸性。
A.据电荷守恒有![]() ,故A错误;
,故A错误;
B.据物料守恒有![]() ,故B正确;
,故B正确;
C.![]() ,说明
,说明![]() 的电离程度大于其水解程度,溶液显酸性,溶液显酸性,故C错误;
的电离程度大于其水解程度,溶液显酸性,溶液显酸性,故C错误;
D.据物料守恒有![]() ,故D正确;
,故D正确;
故答案为BD


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
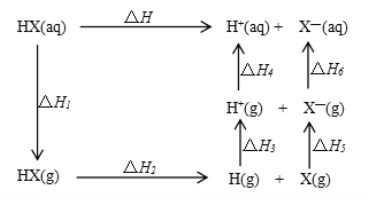
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
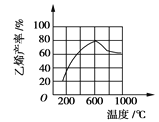
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法不正确的是( )
A.煤的气化、液化、干馏和石油的裂化、裂解、催化重整都是化学变化
B.向污水中投放明矾,利用生成的胶体净水:![]()
![]() 胶体
胶体![]()
C.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g。该混合气体由哪两种烃组成( )
A.甲烷和丙烯B.甲烷和丁烯C.乙烷和乙烯D.乙烷和丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比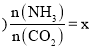 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com