
【题目】已知反应
①![]()
②稀溶液中,![]() ,
,
下列结论正确的是![]()
A.碳的燃烧热为![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 浓
浓![]() 与1molNaOH溶液混合,产生
与1molNaOH溶液混合,产生![]() 热量
热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出![]() 热量
热量
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
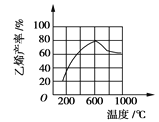
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法不正确的是( )
A.煤的气化、液化、干馏和石油的裂化、裂解、催化重整都是化学变化
B.向污水中投放明矾,利用生成的胶体净水:![]()
![]() 胶体
胶体![]()
C.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
D.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃和某单烯烃的混合气体2.24 L(标准状况),使其完全燃烧,产生的气体完全通过浓硫酸,浓硫酸质量增加4.50 g,剩余气体通过碱石灰,碱石灰质量增加了7.70 g,另取该混合气体2.24 L(标准状况),通过足量溴水,溴水质量增加了1.40 g。该混合气体由哪两种烃组成( )
A.甲烷和丙烯B.甲烷和丁烯C.乙烷和乙烯D.乙烷和丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
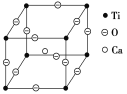
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,在浓度为
时,在浓度为![]() 的
的![]() 、
、![]() 、
、![]() 的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是
的溶液中,已知醋酸的电离常数约等于一水合氨的电离常数,下列判断正确的是![]()
A.由水电离出的![]() 最大的是
最大的是![]()
B.三种溶液的pH值最小的![]()
C.三种溶液中![]() 最大的是
最大的是![]()
D.三种溶液中只有![]() 显碱性
显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgI为黄色沉淀,AgCl为白色沉淀,![]() 时,AgI饱和溶液中
时,AgI饱和溶液中![]() 为
为![]() ,AgCl饱和溶液中
,AgCl饱和溶液中![]() 为
为![]() 。若在5mL含有KCl和KI浓度均为
。若在5mL含有KCl和KI浓度均为![]() 的混合溶液中,滴加8mL
的混合溶液中,滴加8mL![]() 的
的![]() 溶液,则下列叙述中不正确的是
溶液,则下列叙述中不正确的是
A.溶液中所含溶质的离子浓度大小关系为:![]()
B.溶液中先产生的是AgI沉淀
C.AgCl的![]() 的数值为
的数值为![]()
D.在AgI悬浊液中滴加KCl溶液,可能使黄色沉淀转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比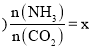 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
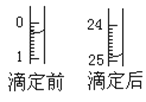
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com