
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
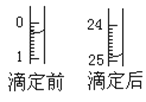
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
【答案】酸 容量瓶 读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL 24.60 酚酞 滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色 无影响 偏高 偏低
【解析】
(1)酸性溶液存放在酸式滴定管中;滴定管读数要估读一位;
(2)根据NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂;
(3)根据c(待测)=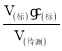 分析不当操作对c(待测)的影响,以此判断浓度的误差;
分析不当操作对c(待测)的影响,以此判断浓度的误差;
(1)盐酸是酸性溶液,存放在酸式滴定管中;配制一定物质的量浓度溶液主要仪器为容量瓶;读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL;滴定前读数为:0.30mL,滴定后读数为:24.90mL,消耗溶液的体积为24.60mL;故答案为:酸;容量瓶; 读数时,眼睛应平视液体凹液面的最低点;读数应到0.01mL; 24.60;
(2)NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择碱性变色范围内的指示剂酚酞;滴定终点:滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色故答案为:酚酞;滴入最后一滴盐酸时溶液变由红色变无色且半分钟内不褪色;
(3)a.若滴定前用蒸馏水冲洗锥形瓶,待测液的物质的量不变,对V(标)无影响,根据计算公式可知c(待测)无影响;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,造成V(标)偏大,根据计算公式可知可知c(待测)偏高;
c.读数时,若滴定前仰视,滴定后俯视,造成V(标)偏小,根据计算公式可知可知c(待测)偏低;
故答案为:无影响;偏高;偏低


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知反应
①![]()
②稀溶液中,![]() ,
,
下列结论正确的是![]()
A.碳的燃烧热为![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 浓
浓![]() 与1molNaOH溶液混合,产生
与1molNaOH溶液混合,产生![]() 热量
热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出![]() 热量
热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中金属腐蚀难以避免。对图a和图b的分析合理的是
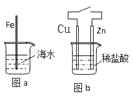
A.图a,负极上发生的反应是:O2+4e+2H2O → 4OH-
B.图b,接通开关后溶液中的H+向正极移动
C.图a,插入海水中的铁棒,越靠近底端腐蚀越严重
D.图b,接通开关后Zn腐蚀速率增大,Zn上放出气体的速率也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
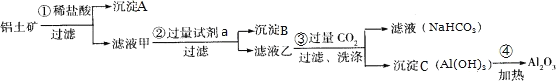
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:
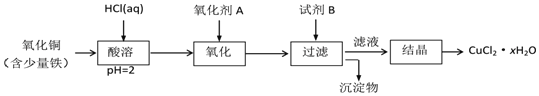
已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列原子或离子的电子排布的表示方法中,正确的是___,违反了能量最低原理的是___,违反洪特规则的是__。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:![]()
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(2)基态Al原子中,电子填充的最高能级是___,基态Cr原子的价电子排布式是___。
(3)用“>”或“<”填空:
第一电离能 | 沸点 | 离子半径 |
Be___B | H2S___H2O | Al3+___O2- |
(4)卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为___,铁在周期表中的位置为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如图所示。
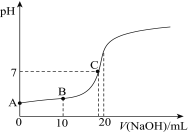
(1)A点溶液pH > 1,用电离方程式解释原因:___________________。
(2)下列有关B点溶液的说法正确的是_______(填字母序号)。
a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d.微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(3)C点溶液中离子浓度的大小顺序:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com