
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
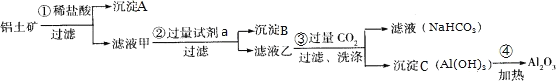
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:
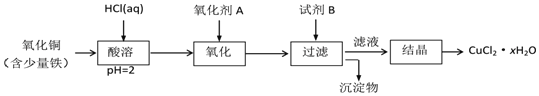
已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
【答案】![]() NaOH 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有
NaOH 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有![]() ,否则不含
,否则不含![]() C B BC 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C B BC 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【解析】
(1)铝土矿中加入过量稀盐酸,过滤得到沉淀A和滤液甲,沉淀A为SiO2,滤液甲中加入过量试剂a为NaOH溶液,过滤分离出沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过量二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝生成氧化铝;
(2)含少量铁的氧化铜中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑、CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,除杂时不能引入新的杂质,A可能为过氧化氢或氯气等;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,B为CuO等,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,以此来解答。
(1)①由上述分析可知,沉淀A为SiO2,步骤②中的试剂a是NaOH;
②检验所得滤液甲中存在Fe3+的操作方法为取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+;
(2)①氧化剂A可选用氯气,其它选项均引入新杂质,故答案为:C;
②试剂B可选用CuO,其它选项均引入新的离子,故答案为:B;
③试剂B的作用是使Fe3+完全沉淀、提高溶液的pH,故答案为:BC;
④从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
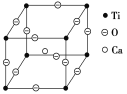
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
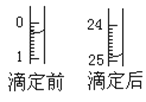
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
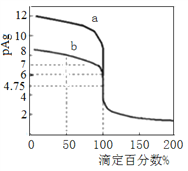
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com