
【题目】H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D.c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
【答案】A
【解析】
A.电荷守恒式c(Cl-)+2c(S2-)+c(HS-)+c(OH-)=c(Na+)+c(H+),物料守恒式c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),pH=7的溶液c(OH-)=c(H+),三等式联立可得c(Cl-)=c(HS-)+2c(H2S),故A正确;
B.通入HCl气体之前,该溶液为Na2S溶液,分步水解且程度很小,离子浓度大小关系为c(S2-)>c(OH-)>c(HS-)>c(H+),故B错误;
C.c(Cl-)+c(OH-)=c(H+)+c(HS-)+2c(H2S),两边同时加上c(S2-),得c(Cl-)+c(OH-)+c(S2-)=c(H+)+c(HS-)+c(S2-)+2c(H2S),因c(HS-)=c(S2-)碱性溶液,所以c(Cl-)+c(HS-)<c(HS-)+c(S2-)+2c(H2S),又因0.100molL-1=![]() c(Na+)=c(S2-)+c(HS-)+c(H2S),所以c(Cl-)+c(HS-)<0.100 molL-1+c(H2S),故C错误;
c(Na+)=c(S2-)+c(HS-)+c(H2S),所以c(Cl-)+c(HS-)<0.100 molL-1+c(H2S),故C错误;
D.c(Cl-)=0.100 molL-1的溶液中,c(S2-)+c(HS-)+c(H2S)=c(Cl-)=0.100molL-1,又因c(Cl-)+c(OH-)=c(H+)+c(HS-)+2c(H2S),所以c(OH-)-c(H+)=c(HS-)+2c(H2S)-[c(S2-)+c(HS-)+c(H2S)]=c(H2S)-c(S2-),故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
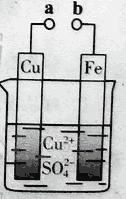
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g) + 3B(g) = 2C(g) + D(g),下列表示反应速率最快的是( )
A. υ(A) =0.5mol·L-1·min-1B. υ(B)=1.2mol·L-1·min-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol
②C(s)+![]() O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
③2C(s)+2O2(g)=2CO2(g) △H=-787 kJ/mol
回答下列问题:
(1)C(s)的标准燃烧热为______ 。
(2)写出CO燃烧的热化学方程式______。
(3)反应①经常用于实验室的中和热测定,测定装置如图1所示:

仪器A的名称是______,碎泡沫塑料的作用是______,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会______57.3 kJ/mol(填“大于”、“小于”或“等于”)。
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图2为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式 ______。
②用该电池电解饱和食盐水,当有1 molH2反应时,所产生的氯气用于制备漂白粉,可以制的漂白粉 ______克。
(5)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图3所示:
①写出该电池反应的总反应方程式:______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图3虚线框内所示位置作出修改,并用箭头标出导线中电子流动的方向________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
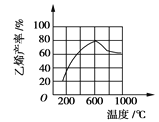
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
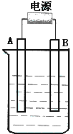
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是

A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
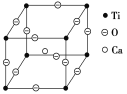
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com