
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料。工业上提取铝的工艺流程如下:
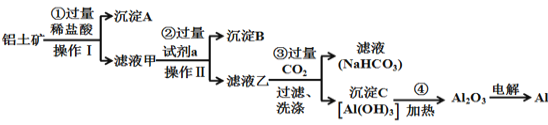
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是:___________________;
(2)沉淀A的化学式是__________;
(3)步骤③中通入过量CO2,产生沉淀C的离子方程式为_________________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为____________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是___________;
a. MgO b. V2O5 c. Fe3O4 d. MnO2
(6)我国首创以铝—空气—海水电池为能源的新型电池,用作海水标志灯已研制成功。该电池以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。负极材料是铝,正极材料可以用石墨。写出正极电极反应式___________。
【答案】增大固液接触面积,加快反应速率,增大原料的浸取率 SiO2 AlO2+CO2+2H2O=Al(OH)3↓+ HCO3 2Al2O3(熔融)![]() 4Al+3O2↑ a 2H2O +O2+4 e=4OH
4Al+3O2↑ a 2H2O +O2+4 e=4OH
【解析】
铝土矿中加入过量试剂a,然后操作I得到沉淀A和滤液甲,则操作I为过滤,滤液甲中加入过量NaOH溶液操作II后得到沉淀B和滤液乙,操作II是过滤;Al2O3、SiO2能溶于强碱溶液而Fe2O3不溶于强碱溶液,SiO2不溶于稀盐酸而Fe2O3、Al2O3能溶于稀盐酸,根据图知,滤液甲中含有铝元素,则试剂a为稀盐酸,沉淀A为SiO2,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝。
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是增大固液接触面积,加快反应速率,增大原料的浸取率;
(2)通过以上分析知,沉淀A为SiO2,故答案为:SiO2;
(3)步骤③中通入过量CO2气体生成的氢氧化铝,离子方程式为:AlO2+CO2+2H2O=Al(OH)3↓+ HCO3;
(4) 工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为: 2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(5)铝热反应是铝粉把某些金属氧化物当中的金属置换出来的反应,该反应将会放出大量的热,其中铝粉和金属氧化物作为铝热剂,镁条和氯酸钾作为引燃剂,作为铝热剂的金属氧化物有:氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬、二氧化锰等,题目要求选择不能作铝热剂的,故选a;
(6)题干已经指明,该电池的电极总反应是Al与O2的反应。反应中Al失电子,应为原电池的负极;O2得电子,应为原电池的正极,正极电极反应式为:2H2O +O2+4 e=4OH。


科目:高中化学 来源: 题型:
【题目】在两个固定容积均为1L密闭容器中以不同的氢碳比![]() 充入
充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]() 的平衡转化率
的平衡转化率![]() 与温度的关系如图所示.下列说法正确的是
与温度的关系如图所示.下列说法正确的是![]()
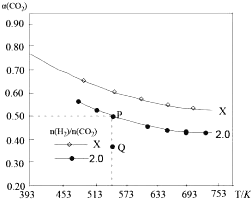
A.该反应在高温下自发进行
B.X的氢碳比![]() ,且Q点在氢碳比为
,且Q点在氢碳比为![]() 时
时![]()
C.若起始时,![]() 、
、![]() 浓度分别为
浓度分别为![]() 和
和![]() ,则可得到P点,对应温度的平衡常数的值为512
,则可得到P点,对应温度的平衡常数的值为512
D.向处于P点状态的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过。锂离子电池的总反应为xLi +Li1-xMn2O4![]() LiMn2O4,下列有关说法错误的是
LiMn2O4,下列有关说法错误的是

A. 放电时,Li+穿过固体薄膜进入到水溶液电解质中
B. 放电时,正极反应为Li1-xMn2O4+xLi++xe-![]() LiMn2O4
LiMn2O4
C. 该电池的缺点是存在副反应:2Li +2H2O![]() 2LiOH+H2↑
2LiOH+H2↑
D. 充电时,电极b为阳极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
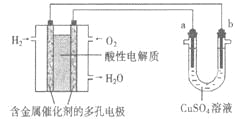
A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。
D.若a、b两极均是石墨时,b极反应为4OH-- 4e-=O2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置制取少量溴苯,请回答下列问题:
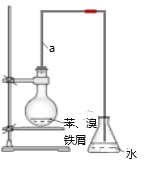
(1)写出实验室制取溴苯的化学方程式___________________。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是_______________你认为这一现象能否说明溴和苯发生了取代反应理由是__________。
(3)该装置中长直导管A的作用_________,锥形瓶中的导管为什么不插入液面下?_______________。
(4)反应后得到的溴苯中溶有少量苯、溴、二溴苯、溴化铁和溴化氢等杂质,将圆底烧瓶内的液体依次进行下列实验操作就可得到较纯净的溴苯。
a.蒸馏水洗涤,振荡,分液;
b.用5%的NaOH溶液洗涤,振荡,分液;
c.用蒸馏水洗涤,振荡,分液;
d.加入无水CaCl2粉末干燥;
e._________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①![]() 、
、![]() 、
、![]() 属于碱性氧化物,
属于碱性氧化物,![]() 、
、![]() 、
、![]() 都能和碱溶液发生反应属于酸性氧化物
都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③混合物:漂白粉、水玻璃、![]() 胶体、冰水混合物
胶体、冰水混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,铝在浓硫酸中钝化均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A.①③⑤B.④⑤⑥C.②④⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
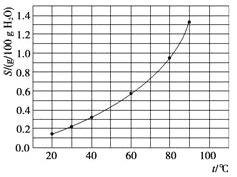
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com