
【题目】下列离子方程式书写正确的是( )
A.向硫酸酸化的FeSO4溶液中加入过量的H2O2溶液:2Fe2++H2O2+2H+═2Fe3++2H2O
B.用小苏打治疗胃酸过多:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
C.碳酸镁与盐酸反应:CO ![]() +2H+═CO2↑+H2O
+2H+═CO2↑+H2O
D.向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO ![]() +OH﹣═CaCO3↓+H2O
+OH﹣═CaCO3↓+H2O
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①相同温度下,同浓度的5中溶液中,水的电离程度的大小顺序为:E=B>C>A=D
②B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
③浓度均为0.1mol·L-1 C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是___________,E是___________;
(2)用水稀释0.1mol·L-1 B溶液时,溶液中随着水量的增加而减小的是_________(填写序号)
a. ![]() b.
b. ![]() c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是_____________(填写序号)。
a.反应所需要的时间E>A b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E d.E溶液里有镁粉剩余
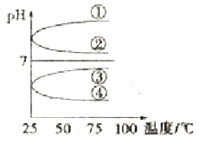
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中________曲线(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 乙烯、聚乙烯和苯分子中均含有碳碳双键
B. 苯、油脂均不能使酸性高锰酸钾溶液褪色
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如图1: 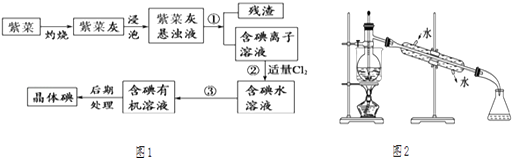
(1)实验室焙烧紫菜,需要下列仪器中的(填序号).
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① , ③ .
(3)提取碘的过程中,可选择的有机试剂是
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是 .
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有、 .
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察图2中的实验装置图改正其中的错误之处:
①;②;③ .
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数.C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个.试写出:
(1)A、C的元素符号分别为、 .
(2)D原子的原子结构示意图为 , B+的离子结构示意图 .
(3)写出与D离子具有相同核外电子数且带4个原子核的分子的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=4.0×10﹣3mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A. 用溴水鉴别苯和正己烷
B. 用BaCl2溶液鉴别SO42-与SO32-
C. 用浓HNO3与Cu反应制备NO2
D. 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠﹣过氧化氢加合物(xNa2SO4yH2O2zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100.00mL溶液A.②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000molL﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00mL.H2O2与KMnO4反应的离子方程式如下:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10﹣10 , 欲使溶液中c(SO42﹣)≤1.0×10﹣6 molL﹣1 , 应保持溶液中c(Ba2+)≥molL﹣1 .
(2)上述滴定若不加稀硫酸酸化,MnO4﹣被还原为MnO2 , 其离子方程式为
(3)上述滴定到达终点的现象为
(4)通过计算确定样品的组成(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属冶炼的反应原理错误的是
A. 2NaCl(熔融)=== 2Na+Cl2↑B. Al2O3+ 3H2 ===2Al + 3H2O
C. Fe2O3 + 3CO === 2Fe + 3CO2D. ZnO + CO === Zn + CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com