
����Ŀ������������⣺
��1������������:��NaOH��Fe��NaHCO3��CH3COOH��NH4Cl��H2O��ϡ������ NH3��H2O
����ǿ����ʵ���__________;����������ʵ���__________��������ţ�
��2�������������ֳƱ����ᡣ��һ���¶���,�������ˮϡ������,��Һ�ĵ�������I�����ˮ�����V�仯��������ͼ��ʾ����ش�:
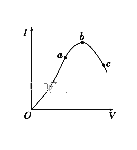
�� ��O���㵼������Ϊ0��������__________��
��a��b��c���㴦,��Һ��c(H+)��С�����˳��Ϊ__________��
��a��b��c���㴦,����̶�������__________��
��ʳ�ð״��У�����Ũ��ԼΪ1mol/L,��֤������Ϊ������ʵ�����_____��
A.�״��е���ʯ����Һ�ʺ�ɫ
B. pH��ֽ��ʾ�����pHΪ2��3
C.���ǽ����ڰ״���������ų�
D. �״��붹�����г�������
E. ȡ��10 mL���ᣬ��pH�Ʋ����pHΪa��Ȼ��������ˮϡ����100 mL������pH�Ʋ����pHΪb ��b��a+1
���𰸡��٢ۢ� �ܢޢ� ������δ���� c��a��b c BF
��������
��1����ȫ����ĵ����Ϊǿ����ʣ�ǿ�ᡢǿ��ʹ��������ǿ����ʣ����ֵ���ĵ������������ʣ��������������������ʣ�
��2����-����Һ�ĵ�����������Ũ���йأ�����Ũ��Խ������Խǿ����������Խǿ������Ũ��Խ��������Ũ��Խ��������ʡ���ˮϡ�ͣ��ٽ����룻
��ǿ������ʵĸ��������������̶ȣ�ֻҪ��֤�����Ჿ�ֵ������֤��������������ʣ����Ը���һ��Ũ�ȴ���pH����������Һ����Եȷ����жϡ�
��1������ǿ����ʵ�Ϊ�٢ۢݣ�����������ʵ�Ϊ�ܢޢࣻ
��2���� ��O���㵼������Ϊ0˵����Һ��û�������ƶ����������ӣ���������δ���룻
����Һ������Ũ��Խ���䵼����Խǿ���������������Ũ�ȴ�С��ϵΪc��a��b��
�۶���������ʣ���ҺԽϡ�������̶�Խ����̶�����Ϊc�㣻
��A. ����ʯ��ʺ�ɫ��˵����Һ���������ӣ���֤����Ϊ������ʣ�
B. 1mol/L�Ĵ�����Һ��pHΪ2-3��˵���䲻��ȫ���룬����֤����Ϊ������ʣ�
C. ���ǿ���״�Ӧ��������˵�����к��������ӣ���֤����Ϊ������ʣ�
D. �״��붹�����г���������˵���״�Ϊ����ʣ���֤����ǿ����
E. ȡ��10 mL���ᣬ��pH�Ʋ����pHΪa��Ȼ��������ˮϡ����100 mL������pH�Ʋ����pHΪb ��b��a+1��˵���䲻��ȫ���룬����֤����Ϊ������ʣ�
��ѡBF��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������£�![]()
![]() ��
��![]() ��ij��Ԫ��
��ij��Ԫ��![]() �������ε���Һ�У�
�������ε���Һ�У�![]() ��
��![]() ��
��![]() �ֱ���������ռ�����ʵ�������
�ֱ���������ռ�����ʵ�������![]() ����ҺpH�仯��ϵ��ͼ��ʾ�����������������
����ҺpH�仯��ϵ��ͼ��ʾ�����������������
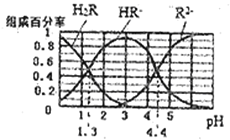
A.��![]() ����Һ�У�
����Һ�У�![]()
B.�������Ũ�ȵ�NaOH��Һ��![]() ��Һ��Ϻ���Һ��ˮ�ĵ���̶ȱȴ�ˮС
��Һ��Ϻ���Һ��ˮ�ĵ���̶ȱȴ�ˮС
C.��![]() ����Һ�д���
����Һ�д���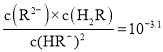
D.��![]() ��Һ�м�������
��Һ�м�������![]() ��Һ��������Ӧ��
��Һ��������Ӧ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п��淴Ӧ��Fe(s)+CO2(g)![]() FeO(s)+CO(g)����֪938Kʱƽ�ⳣ��K=1.47��1173Kʱƽ�ⳣ��K=2.15��
FeO(s)+CO(g)����֪938Kʱƽ�ⳣ��K=1.47��1173Kʱƽ�ⳣ��K=2.15��
(1)�÷�Ӧ��ƽ�ⳣ������ʽ_____________����____________��������������������������Ӧ��
(2)���÷�Ӧ������㶨���ܱ������н��У���һ�������´ﵽƽ��״̬������ı�������������Ӧ��������ƽ����Է���������α仯������������������С����������������
�������¶�_________________������ͨ��CO__________________��
(3)�÷�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��

�ٴ�ͼ�п��Կ�������Ӧt2ʱ�ﵽƽ�⣬��t1ʱ�ı�ij��������������������_____��
A.�����¶� B.����CO2Ũ�� C.ʹ�ô���
�������t3ʱ�ӻ�����з��������CO��t4��t5ʱ��η�Ӧ�����µ�ƽ��״̬������ͼ�ϻ���t3��t5����(��)�仯����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pH=1��������Һ���й�������
�ٸ���Һ1mLϡ����100mL��pH=3
�������Һ�м���������pH=13������������Һǡ����ȫ�к�
�۸���Һ������������c(H+)��ˮ�������c(H+)֮��ֵΪ1��10��12
�������Һ�м�����������Ũ�ȵİ�ˮ��������ҺpH=7
������ȷ����
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ѧ����ʽC(s)��H2O(g) ![]() CO(g)��H2(g)����H ��+131.3kJ/mol��ʾ�� ��
CO(g)��H2(g)����H ��+131.3kJ/mol��ʾ�� ��
A. ̼��ˮ��Ӧ����131.3kJ����
B. 1mol̼��1molˮ��Ӧ����һ����̼������������131.3kJ����
C. 1mol��̬̼��1molˮ������ȫ��Ӧ����һ����̼�����������������131.3kJ����
D. 1����̬̼ԭ�Ӻ�1����ˮ������Ӧ����131.1kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ,���ᡢ̼���������ĵ���ƽ�ⳣ�����±���ʾ:
�� | ����ƽ�ⳣ�� |
���� |
|
̼�� |
|
������ |
|
�������ᷢ������ķ���ʽΪ____________________________________________��
��̼���������ĵ�һ������̶ȴ��ڵڶ�������̶ȵ�ԭ��:_____________________��
������ͬ������,�ԱȽ�![]() ��
��![]() ��
��![]() ������ǿ��:_______> ______>_______��
������ǿ��:_______> ______>_______��
�ܽ�pH=4��![]() ��Һϡ��100������Һ��pH��Χ��______________________,ͼ�е������������_______________________��
��Һϡ��100������Һ��pH��Χ��______________________,ͼ�е������������_______________________��
a.��Һ��pH b.����ĵ���ƽ�ⳣ�� c.��Һ�ĵ������� d.����ĵ���̶�
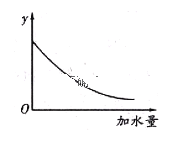
��������ij�ʼŨ��Ϊ0.01 mol/L��ƽ��ʱ������Ũ����________________________��д����ϸ���ⲽ�裩
��д��������������̼���Ʒ�Ӧ�����ӷ���ʽ_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ���ݻ��̶����ܱ��������п��淴Ӧ A2(g) + B2(g)![]() 2AB(g)���ﵽƽ��ı�־��
2AB(g)���ﵽƽ��ı�־��
A.�������������ѹǿ����ʱ��ı仯���仯
B.��λʱ��������n mol A2ͬʱ����2 n mol AB����
C.������������ܶȲ���ʱ��ı仯���仯
D.��λʱ������n mol B2����ͬʱ����n mol AB�ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ����������⻯����NaBH4��BԪ�صĻ��ϼ�Ϊ+3�ۣ���H2O2��ԭ�ϵ�ȼ�ϵ�أ��������ϲ���Pt/C���������ϲ���MnO2���������վ�ͨ�����ǵ�Դ���乤��ԭ����ͼ��ʾ������˵���������
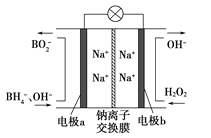
A. ��طŵ�ʱNa+��a��������b����
B. �缫b����MnO2��MnO2�����缫�������д�����
C. �õ�صĸ�����ӦΪ��BH4��+8OH�D�D8e��=BO2��+6H2O
D. ÿ����3molH2O2��ת�Ƶĵ���Ϊ3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����廯����A��ˮ��Һ�����ԣ����A���������ǻ���A�ɷ�����ͼ��ʾת��������FΪ��Ԫ��״�����G��ʹ������Ȼ�̼��Һ��ɫ��F��G��Ϊͬ�������壻H��I����ҽ�ø߷��Ӳ��ϡ�

��ش�
��1��E�еĹ������������ǻ��� ��
��2���۵ķ�Ӧ������ ��
��3���ڵĻ�ѧ����ʽ�� ��
��4��A��H�Ľṹ��ʽ�ֱ��� �� ��
��5��D������X��Һ��Ӧ��ɵõ�C7H5O3Na����X��Һ���������ʵĻ�ѧʽ�� ��
��6����������������G��ͬ���칹������һ�־��з�ʽ�ṹ���÷�ʽ�ṹ�� ���ýṹ��ʽ��ʾ����
���ܷ���ˮ�ⷴӦ
�ڷ����в�����״�ṹ
�ۺ˴Ź���������ʾ��������4�ֲ�ͬ��ѧ��������ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com