
| A. | 铝粉投入到少量NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+═3Fe2+ |
分析 A.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒;
B.次氯酸为弱酸,离子方程式中不能拆开;
C.氨水为弱碱,离子方程式中一水合氨不能拆开;
D.氯化铁与铁粉反应生成氯化铁.
解答 解:A.铝粉投入到少量NaOH溶液中,反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B.氯气和水反应生成氯化氢和次氯酸,次氯酸需要保留分子式,正确的离子方程式为:Cl2+H2O?H++Cl-+HClO,故B错误;
C.氯化铝与氨水反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.铁粉加入三氯化铁溶液中,反应生成氯化亚铁,反应的离子方程式为:2Fe+Fe3+═3Fe2+,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).


科目:高中化学 来源: 题型:选择题
| A. | 制取等量硝酸铜,需硝酸的量②最少 | |
| B. | 制取等量的硝酸铜,②产生的有毒气体比①少 | |
| C. | 三种方案中,第③方案最经济环保 | |
| D. | 三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al$→_{△}^{O_{2}}$Al2O3 $\stackrel{HNO_{3}}{→}$Al(NO3)3$→_{△}^{蒸干}$Al(NO3)3晶体 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| C. | Fe$→_{点燃}^{Cl_{2}}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| D. | NaOH溶液$\stackrel{SO_{2}}{→}$Na2SO3$\stackrel{SO_{2}}{→}$NaHSO3$→_{灼烧}^{蒸干}$Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C16H18O9 | |
| B. | 在一定条件下能发生消去反应 | |
| C. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 标签上给出的离子的物理量是物质的量浓度 | |
| B. | 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之内 | |
| C. | 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L | |
| D. | 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过1×10-5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
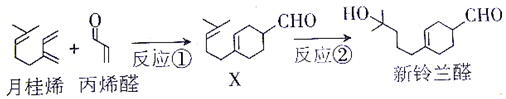
| A. | 反应①属于加成反应 | |
| B. | 新铃兰醛能发生消去反应 | |
| C. | 检验新铃兰醛中是否混有醛X,可用溴水 | |
| D. | 1mol新铃兰醛完全燃烧需消耗17.5mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com