
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):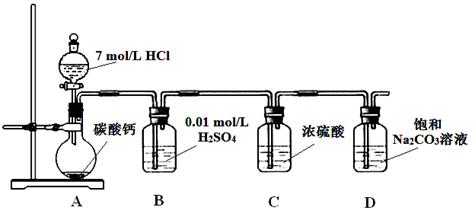
(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。
a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))= 。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
(1)Na2CO3+CO2+H2O = 2NaHCO3 (2分)
(2)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3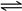 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
(3)① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分)
② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分)
合理(1分)
③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分)
补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分)
a.白色固体为NaHCO3(2分)
b.71:42(或1.69)(1分)
解析试题分析: A装置中反应制备CO2,其中有杂质HCl、H2O(g),B装置既减少CO2的溶解,又能吸收HCl,C装置干燥CO2,D装置制备碳酸氢钠。(3)Na2CO3和NaHCO3都能和Ca(OH)2反应生成白色沉淀,方案1不合理,方案2 Na2CO3和BaCl2反应有白色沉淀,NaHCO3和BaCl2反应有白色沉淀和气体,因此可以确定NaHCO3存在,但不能确定Na2CO3的存在。方案3 Na2CO3和NaHCO3溶液都显碱性,但水解程度不同,可通过比较PH值前后大小进行区别。乙同学在温度为180时,残留率正好符合NaHCO3完全分解的计算,B点根据差量法进行计算,设原来有100克NaHCO3,反应后剩余80克,减少20克是CO2和H2O的质量,列方程组计算。
考点:考查化合物的制备、基本实验原理、实验设计、方程式的书写、物质的量的计算


科目:高中化学 来源: 题型:实验题
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。
(l)盛放稀硫酸的仪器名称为 ;
(2)试剂X为 ,试剂Y为 ;
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) ;
| A.读数前应使整套装置冷却至室温 |
| B.调整Z的高度使量气装置左右液面相平 |
| C.读数时视线与Z内凹液面最低点相切 |
| D.读数前应通入一定量的N2使生成的CO2全部进入量气装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: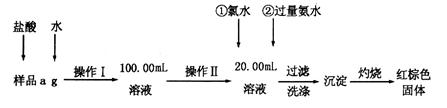
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________________________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式____________________。
(3)检验沉淀已经洗涤干净的操作及现象是______________________________________
___________________________________________________________________________。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________(列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________(写出一种原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下: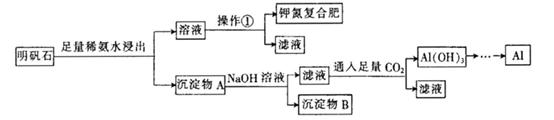
回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有 ________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L?1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2?3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法 是 。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4 ],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下: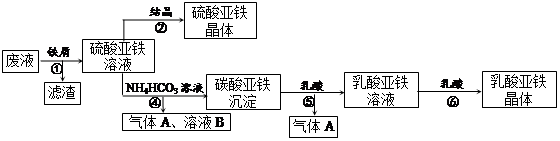
请回答:
(1)步骤①中分离操作的名称是_______;步骤⑥必须控制一定的真空度,原因是______________
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为_________
_ ;步骤④的离子方程式为____________________________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因______________________________。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:
_____ Fe2+ + _____ MnO4- + _____ H+ = _____Fe3+ +_____ Mn2+ +_____
取步骤②所得晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1 KMnO4溶液20.00mL,则所得晶体中FeSO4? 7H2O的质量分数为(以含a的式子表示) _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。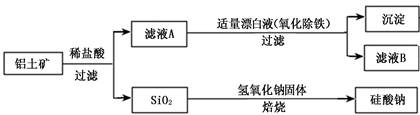
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O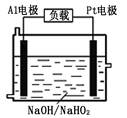
①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为 。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是 。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。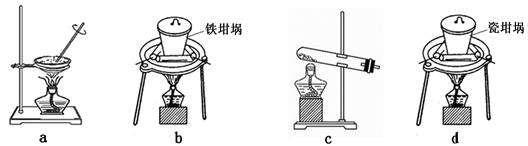
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A.青石棉是一种硅酸盐产品 |
| B.青石棉中含有一定量的石英晶体 |
| C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| D.1 mol青石棉能使1 mol HNO3被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2,下列说法中错误的是 ( )
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
光具有能量,能影响很多反应。下列反应中,受光照影响显著的是
| A.乙醇与乙酸的酯化反应 | B.甲烷与氧气的反应 |
| C.铁与氯气的反应 | D.次氯酸的分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com