
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如下: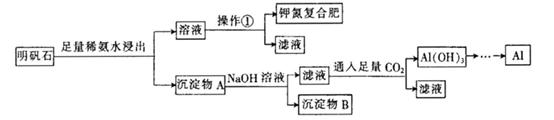
回答下列问题:
(1) 明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为________________
(2) 沉淀物A中除含有Fe2O3外,还含有 ________、________。
(3) 操作①的名称为________、冷却结晶、过滤。
(4) 用14mol . L-1的浓氨水配制480 mL 2 mol . L?1稀氨水:
①所用的容量瓶规格是________。
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?________________________
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:________。
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2?3次,并将洗涤液转人容量瓶中: 。
(5) 确定钾氮复合肥中含有钾元素的方法 是 。
(6) 为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL。则钾氮复合肥中氮元素的质量分数为________ (用含m、V的代数式表示)。
(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(2)Al(OH)3;Al2O3 (各1分)
(3)蒸发浓缩 (1分)
(4)①500mL (1分)
②取适量的蒸馏水沿玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2~3次 (2分)
③无影响;偏大 (各2分)
(5)焰色反应 (1分)
(6)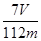 % (3分)
% (3分)
解析试题分析:工艺流程题解题的关键是搞清楚加入什么物质,发生什么反应,如何分离。要将一个工艺的流程转化为物质的流程。该题中首先是在KAl(SO4)2、Al2O3、Fe2O3中加入氨水,只有Al3+发生反应转化为沉淀,然后是有过滤方法分离,得到滤液K+、SO42-、NH3·H2O等,固体为Al(OH)3、Al2O3、Fe2O3等,然后再固体中加入NaOH,铝转化为NaAlO2溶液,固体为Fe2O3,最终得到所需物质。
(6)氮的质量为 ×17g/mol;质量分数为;
×17g/mol;质量分数为;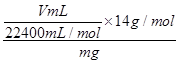 ×100%=
×100%=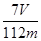 %
%
考点:本题以工艺流程题为基础,考查了元素及化合物知识、化学实验基本操作、物质检验、化学计算等相关知识。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:实验题
铁不能与冷、热水反应,但是能与水蒸气反应。实验装置如图所示。在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。请回答: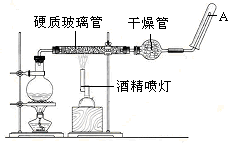
(1)写出该反应的化学方程式 。
(2)实验前必须对整套装置进行的操作是________,实验开始时应先点燃 (填“酒精灯”或“酒精喷灯”),实验结束时应先熄灭 (填“酒精灯”或“酒精喷灯”)。
(3)圆底烧瓶中盛有水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 ;干燥管中盛装的物质是________。
(4)待硬质玻璃管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B,取少量溶液B滴加 溶液,若 (填实验现象),则说明溶液B中含有Fe3+。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应 ① ;二是发生互促水解反应 ② 。
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色。这种红褐色液体是 ③ 。
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色。将所得溶液分成两等份:
其中一份加入KSCN溶液,溶液变成血红色,此步实验的目的是 ④ ;另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 ⑤ 。
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同。
同学们由上述实验得出的结论是 ⑥ 。
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为 ⑦ ;检验的目的是 ⑧ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。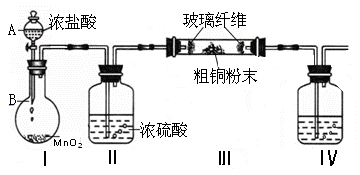
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42- (aq) +4H2O(l)
CuCl42- (aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b. 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。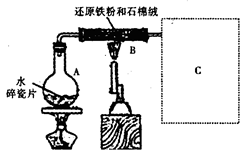
(1)装置B中发生反应的化学方程式是 。
(2)虚线框图C的气体收集装置是下图中的 (选填字母编号)。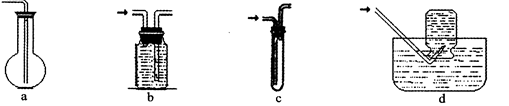
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验: 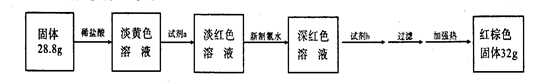
试剂a的化学式是 ,试剂b的化学式是 ;加入新制氯水后溶液红色加深的原因是(用离子方程式表示) 。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;假设2:
;为了对所提出的假设2进行验证,实验方案是
。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定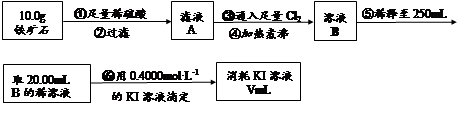
(3)步骤④中煮沸的作用是 。
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(5)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(6)若滴定过程中消耗0.4000mol·L?1KI溶液25.00ml,则铁矿石中铁的百分含量为 。
Ⅲ.(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):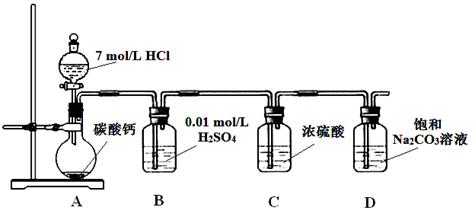
(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。
a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))= 。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是 ( )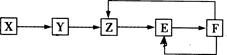
| A.M元素可能是非金属元素,也可能是金属元素 |
| B.X可能是一种氢化物 |
| C.E可能是一种有色气体 |
| D.X→Y可能是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
勤洗手和经常对环境进行消毒是预防传染病的有效途径。2012年4月,H7N9疫情爆发,可以用某种消毒液进行消毒,预防传染。已知该消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
| A.KMnO4 | B.H2O2 | C.NaClO | D.NH3·H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com