
【题目】电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100molL-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
科目:高中化学 来源: 题型:
【题目】求下列溶液的pH(常温条件下)(已知lg2=0.3)
(1)0.005 mol·L-1的H2SO4溶液________
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1 mol·L-1的CH3COOH溶液________
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=![]() ×100%)________
×100%)________
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合________
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合________
(6)将pH=3的HCl与pH=3的H2SO4等体积混合________
(7)0.001 mol·L-1的NaOH溶液________
(8)pH=2的盐酸与等体积的水混合________
(9)pH=2的盐酸加水稀释到1 000倍________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,不合理的是( )

A. 用a趁热过滤提纯苯甲酸B. 用b制备并检验乙烯
C. 用c除去溴苯中的苯D. 用d分离硝基苯与水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1mol苯甲酸乙酯
B.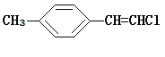 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种
D.1mol阿司匹林(结构简式见图)与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2mol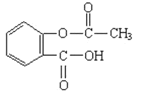
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol·L-1稀盐酸、0.500 mol·L-1 的NaOH溶液来制备一水硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制取
①实验室用铜与浓硫酸制备硫酸铜溶液时,往往会产生有污染的SO2气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
②实际生产中往往将铜片在空气中加热,使其氧化生成CuO,再溶解在稀硫酸中即可得到硫酸铜溶液;这一过程缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
③所以工业上进行了改进,可以在浸入硫酸中的铜片表面不断通 O2,并加热;也可以在硫酸和铜的混合容器中滴加 H2O2 溶液。
④趁热过滤得蓝色溶液。
(1)某同学在上述实验制备硫酸铜溶液时铜有剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因________________。
(2)若按③进行制备,请写出Cu在H2O2 作用下和稀硫酸反应的化学方程式_______________。
(3)H2O2溶液的浓度对铜片的溶解速率有影响。现通过下图将少量30%的H2O2溶液浓缩至40%,在B处应增加一个设备,该设备的作用是____________馏出物是 ______________________。


II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
(1)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为 Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(2)继续滴加 NH3·H2O,会转化生成深蓝色溶液,请写出从深蓝色溶液中析出深蓝色晶体的方法____________。并说明理由____________。
Ⅲ.产品纯度的测定
精确称取 mg 晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量 NaOH 溶液, 通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 V1mL 0.500mol·L-1 的盐酸标准溶液完全吸收。取下接收瓶,用 0.500 mol·L-1 NaOH 标准溶液滴定过剩的 HCl(选用 甲基橙作指示剂),到终点时消耗 V2mLNaOH 溶液。

1.水 2.长玻璃管 3.10%NaOH溶液 4.样品液 5.盐酸标准溶液
(1)玻璃管2的作用________________。
(2)样品中产品纯度的表达式________________。(不用化简)
(3)下列实验操作可能使氨含量测定结果偏低的原因是_________________
A.滴定时未用 NaOH 标准溶液润洗滴定管
B.滴定过程中选用酚酞作指示剂
C.读数时,滴定前平视,滴定后俯视
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
E.由于操作不规范,滴定前无气泡,滴定后滴定管中产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

(1)过滤用到的玻璃仪器有烧杯、玻璃棒、________。
(2)还原过程中发生的主要反应的离子方程式:__________,若将(NH4)2SO3换成铁粉也可得到CuCl,写出离子方程式___________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:______________________________。
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是_____。

(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
①△H3=____kJ/mol。
②在恒定压强、T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中发生I、Ⅲ反应,5 min后反应达到平衡状态,此时CH3OH(g) 物质的量为2mol,CH3OCH3(g)的物质的量为0.5mol;则T1温度时反应I的平衡常数Kc的计算式为______。
③恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图 。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是_____________。
A.210℃ B. 230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
(2)一定条件下,可以通过CO与SO2反应生成S和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的化学方程式___________。在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图所示:
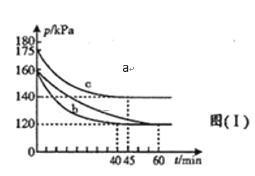
①图中三组实验从反应开始至达到平衡时,反应速率v(CO)最大的为_____(填序号)。
②与实验a相比,c组改变的实验条件可能是___________。
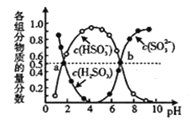
(3)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点时溶液pH=7,则n(NH4+):n(HSO3)=________。
(4)间接电化学法可除NO。其原理如图所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)_____。
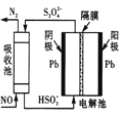
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.ns能级上单个电子的能量不一定高于![]() 能级上单个电子的能量
能级上单个电子的能量
B.基态C原子的电子排布式![]() 违反了洪特规则
违反了洪特规则
C.基态Sc原子的电子排布式![]() 违反了能量最低原理
违反了能量最低原理
D.基态Ti原子的电子排布式![]() 违反了泡利原理
违反了泡利原理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com