
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。

已知:
回答下列问题:
(1)化合物C中的含氧官能团名称为_________,A到B的反应类型为__________。
(2)A的名称为____________
(3)写出D的结构简式:_____________________________。
(4)写出反应②的化学方程式:____________________________________________。
(5)化合物C满足下列条件的同分异构体有_______种,写出其中一种有5种不同种类氢原子的同分异构体的结构简式:_______________。
①含苯环结构,能在碱性条件下发生水解;
②能与FeCl3发生显色反应;
③能发生银镜反应。
(6)已知CH3CH2CN![]() CH3CH2COOH。请以
CH3CH2COOH。请以 、CH2=CHCN和乙醇为原料合成化合物
、CH2=CHCN和乙醇为原料合成化合物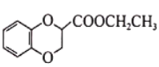 ,写出制备的合成路线流程图(无机试剂任用)____________________
,写出制备的合成路线流程图(无机试剂任用)____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI用于分析试剂、感光材料制药和食品添加剂等。
制备原理如下:反应① 3I2+6 KOH =a KIO3+5KI+3H2O
反应② 3H2S+KIO3=3S↓+KI+3H2O

按照下列实验过程,请回答有关问题。
(1)启普发生器中发生的化学方程式为______________________,用该装置还可以制备___________(填一种气体化学式)。
(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到______________________(填现象),停止滴人KOH溶液;然后______________________(填操作),待KIO3混合液和NaOH溶液气泡速率接近相同时停止通气。
(3)滴人硫酸溶液,并对KI混合液水浴加热,其目的是______________________。
(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和___________,其中加入碳酸钡的作用是______________________。合并滤液和洗液,蒸发至析出结晶,滤出经于燥得成品。
(5)如果得到3.2g硫单质,则理论上制得的KI为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+价电子排布式为___________;[Cu(NH3)4]SO4·H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为___________。
(2)SO42-中S原子轨道杂化类型为___________,H3O+几何构型为___________。
(3)NH3极易溶于H2O中,可能的原因为___________。
(4)N、O、S第一电离能由大到小的顺序为___________。

(5)Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为___________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )

A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3mol NH3分子中所含原子数与__________________个H2O分子中所含原子数相等。
(2)在9.5g某二价金属的氯化物中含有0.2mol Cl-,该金属元素的相对原子质量为_______。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合物中C和O原子个数比是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)等物质的量的Na2CO3和NaHCO3混合溶液中各离子浓度由大到小的顺序为____________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是____________(填“强酸”或“弱酸”);高锰酸是___________(填“强酸”或“弱酸”)。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:__________________________________________________。
(6)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列各选项中正确的是( )
A.1mol/L Na2CO3溶液中的Na+数目为2NA
B.等质量的NO2和N2O4,前者原子数小
C.1L 0.1mol/L NaHCO3溶液中含氧原子数0.3NA
D.常温常压下,0.2mol CO2的体积大于4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体;可溶于水。
(1)制备Na2S2O5(夹持装置略)

① A为SO2发生装置,A中反应方程式是_____________________________________。
② B 中析出白色晶体,可采取的分离方法是___________________。
③ 将尾气处理装置C补充完整并标明所用试剂。___________________
(2) 探究Na2S2O5的性质
实验编号 | 实验操作及现象 |
实验Ⅰ | 取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性。 |
实验Ⅱ | 取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解。 |
实验III | 取B中少量白色晶体于试管中,滴加1mL 2 mol / L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 。 |
实验IV | 取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复。 |
① 由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因_______________________________________(用化学方程式表示) 。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,用平衡原理解释原因______________________。
③ 实验III中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________。
④ 实验IV 中产生的气体为____________,实验中利用该气体的_________ 性质进行检验。
⑤ 从上述实验探究中,体现出Na2S2O5具有 _____________________性质。 ( 至少说出两点 )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com