
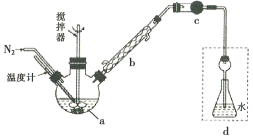
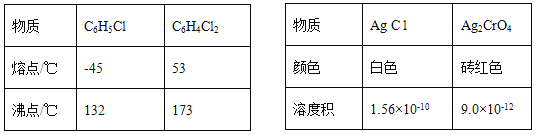
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
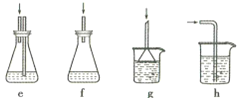
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______;若消耗22.50mL AgNO3溶液,则无水FeCl3的转化率为_____。
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏_______(填“高”或“低”)。
【答案】 三颈烧瓶或三口烧瓶 加快反应速率 将反应生成的HCl全部排至装置d,被水完全吸收 CD 蒸馏滤液,收集132℃的馏分 eg 红色沉淀刚好出现 90% 低
【解析】分析:将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,然后用硝酸银滴定生成的氯化氢测定无水FeCl3的转化率;根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离;分析误差时需要根据c(待测)=
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,然后用硝酸银滴定生成的氯化氢测定无水FeCl3的转化率;根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离;分析误差时需要根据c(待测)=![]() 分析判断。
分析判断。
详解:(1)根据装置图,仪器a是三颈烧瓶,搅拌可以使反应物充分混合,加快反应速率,故答案为:三颈烧瓶;加快反应速率;
(2)反应结束后,继续通入N2,可以将反应生成的HCl全部排至装置d,被水完全吸收,减少实验误差;仪器c的目的是干燥生成的氯化氢,应该选择固态酸性或中性干燥剂,可以选择无水氯化钙或硅胶,故答案为:将反应生成的HCl全部排至装置d,被水完全吸收;CD;
(3)根据表格数据,C6H5Cl 和C6H4C12的沸点相差较大,从滤液中回收过量的氯苯,可以选择蒸馏的方法分离,只要收集132℃的馏分即可,故答案为:蒸馏滤液,收集132℃的馏分;
(4)氯化氢极易溶于水,需要防止倒吸,能代替图中虚线框内部分的有eg,f为密封装置,氯化氢气体不能通入,h会发生倒吸现象,故答案为:cg;
(5) 锥形瓶内的溶液为氯化氢的水溶液,将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,根据表格数据,首先生成氯化银出,后生成铬酸银沉淀,因此终点现象为红色沉淀刚好出现;根据方程式2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,HC1+ AgNO3=AgCl+ HNO3可知,2FeCl3~HC1↑~ AgNO3,n(FeCl3)=2n(AgNO3)=2×0. 2000mol·L-1×0.02250L×
2FeCl3+C6H4C12+HC1↑,HC1+ AgNO3=AgCl+ HNO3可知,2FeCl3~HC1↑~ AgNO3,n(FeCl3)=2n(AgNO3)=2×0. 2000mol·L-1×0.02250L×![]() =0.9mol,无水FeCl3的转化率为
=0.9mol,无水FeCl3的转化率为![]() ×100%=90%,故答案为:红色沉淀刚好出现;90%;
×100%=90%,故答案为:红色沉淀刚好出现;90%;
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会,导致溶液的体积偏小,根据c(待测)=![]() ,测定结果偏低,故答案为:低。
,测定结果偏低,故答案为:低。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子中含两个一CH3、分子式为C5H11Cl的同分异构体有3种
B. HNO3能与苯、甲苯、甘油、纤维素等有机物发生取代反应
C. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
D. 有机物![]() 的一溴代物有4种
的一溴代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种常用的化工原料,如合成氨和尿素[CO(NH2)2]等。
(1)以H2合成CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
(2)电解制H2的原理为C(s)+2H2O(l)![]() CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
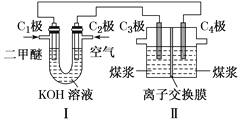
①分别写出电极C1和C3的电极反应式__________________;___________________。
②离子交换膜可能是________(填字母)。
a.阳离子交换膜 b.阴离子交换膜 c.质子交换膜
③已知4.6 g二甲醚参与反应,假设装置Ⅰ的能量转化率为100%,C4极收集到11.2L(标准状况)气体,装置Ⅱ的电流效率η=________。![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL、浓度均为0. 1mol·L-1的两种酸HX、HY溶液中分別滴加0. 1mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是
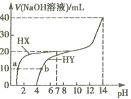
A. HX与NaOH溶液反应的离子方程式为:HX +OH-=X-+H2O
B. Ka(HY)的数量级约为10-10
C. b点时: c(Na+)=c(Y-)+c(HY)
D. V(NaOH)= 20mL时,两种反应后的溶液中c(X-)>c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式: (至少写出5个)。
(2)写出用上述元素组成的物质制得A的单质的化学方程式: 、
(3)检验某溶液中是否含有D+,可通过 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是 和 。
(4)写出E的元素符号: ,要证明太阳上是否含有E元素,可采用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的类别正确的是( )
A.盐:碳酸氢钠 氯化铵 纯碱
B.电解质:H2SO4 Ba(OH)2 CO2
C.氧化物:H2O CO HNO3
D.混合物:空气 玻璃 胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 酸性氧化物 | |
A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
C | 苛性钠 | 醋酸 | 石灰石 | 水 |
D | 苛性钾 | 碳酸 | 苏打 | 三氧化硫 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol/L的氨水滴定10.00 mL 0.1 mol/L的酸HA,所加氨水的体积(V)与溶液中lg![]() 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
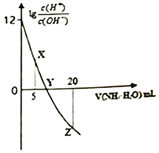
A. X点:c(A-)>c(H+)>c(NH4+)>c(OH-) B. Y点:V(NH3·H2O) <10.00 mL
C. Z点:2c(A-)= c(NH4+)+c(NH3·H2O) D. HA的电离方程式为HA=H++A-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 用铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 nol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com