
����Ŀ�������£���0.1 mol/L�İ�ˮ�ζ�10.00 mL 0.1 mol/L����HA�����Ӱ�ˮ�����(V)����Һ��lg![]() �Ĺ�ϵ��ͼ��ʾ������˵���������
�Ĺ�ϵ��ͼ��ʾ������˵���������
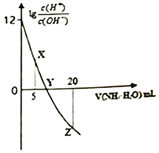
A. X�㣺c(A-)>c(H+)>c(NH4+)>c(OH-) B. Y�㣺V(NH3��H2O) <10.00 mL
C. Z�㣺2c(A-)= c(NH4+)+c(NH3��H2O) D. HA�ĵ��뷽��ʽΪHA=H++A-
���𰸡�B
����������ͼ��֪��0.1 mol/L����HA��lg![]() =12����
=12����![]() =1012��
=1012��![]() =1012��c2(H+)=1012KW=1012
=1012��c2(H+)=1012KW=1012![]() 10-14=10-2��c(H+)=0.1mol/L��˵��HA��ȫ���룬Ϊǿ�ᡣA. X�㣺����5mL0.1 mol/L�İ�ˮ�õ���Ũ�ȵ�NH4A��HA�����Һ��c(A-)>c(H+)>c(NH4+)>c(OH-)��A��ȷ��B. Y�㣺lg
10-14=10-2��c(H+)=0.1mol/L��˵��HA��ȫ���룬Ϊǿ�ᡣA. X�㣺����5mL0.1 mol/L�İ�ˮ�õ���Ũ�ȵ�NH4A��HA�����Һ��c(A-)>c(H+)>c(NH4+)>c(OH-)��A��ȷ��B. Y�㣺lg![]() =0����
=0����![]() =1��c(H+)=c(OH-),��Һ�����ԣ������백ˮV(NH3��H2O) =10.00 mL��ǡ�õõ�NH4A��Һ����ʱ��Һ����NH4+ˮ��������ԣ��ʼ���İ�ˮӦ��10.00 mL��B����C. Z��Ϊ��Ũ�ȵ�NH4A��NH3��H2O�Ļ����Һ�����������غ㣬2c(A-)= c(NH4+)+c(NH3��H2O)��C��ȷ��D. HAΪǿ�ᣬ���뷽��ʽΪHA=H++A-��D��ȷ��������ȷ��ӦѡB��
=1��c(H+)=c(OH-),��Һ�����ԣ������백ˮV(NH3��H2O) =10.00 mL��ǡ�õõ�NH4A��Һ����ʱ��Һ����NH4+ˮ��������ԣ��ʼ���İ�ˮӦ��10.00 mL��B����C. Z��Ϊ��Ũ�ȵ�NH4A��NH3��H2O�Ļ����Һ�����������غ㣬2c(A-)= c(NH4+)+c(NH3��H2O)��C��ȷ��D. HAΪǿ�ᣬ���뷽��ʽΪHA=H++A-��D��ȷ��������ȷ��ӦѡB��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�ҹ���ѧ������ɹ��ϳ������������嵪��������(N5)6(H3O)3(NH4)4Cl����R���������ش��������⣺
��1����ԭ�Ӽ۲���ӶԵĹ������ʽ�������Ų�ͼ��Ϊ_____________��
��2��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų�������������һ�������ܣ�E1�����ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��a����ʾ�����г���Ԫ���⣬����Ԫ�ص�E1����������������ԭ����___________����Ԫ�ص�E1�����쳣��ԭ����__________��
��3����X���������û�����R�ľ���ṹ����ֲ��ṹ��ͼ��b����ʾ��
�ٴӽṹ�Ƕȷ�����R�����������ӵ���֮ͬ��Ϊ_________����֮ͬ��Ϊ__________�������ţ�
A������ԭ�ӵ��ӻ�������� B������ԭ�ӵļ۲���Ӷ���
C������ṹ D�����ۼ�����
��R��������N5-�еĦҼ�����Ϊ________���������еĴ�м����÷���![]() ��ʾ������m���������γɵĴ�м�ԭ������n���������γɵĴ�м����������籽�����еĴ�м��ɱ�ʾΪ
��ʾ������m���������γɵĴ�м�ԭ������n���������γɵĴ�м����������籽�����еĴ�м��ɱ�ʾΪ![]() ������N5-�еĴ�м�Ӧ��ʾΪ____________��
������N5-�еĴ�м�Ӧ��ʾΪ____________��
��ͼ��b�������ߴ�����������ʾʽΪ��NH4+��N-H��Cl��____________��____________��
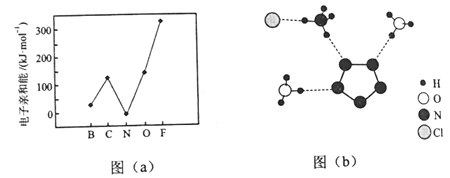
��4��R�ľ����ܶ�Ϊd g��cm-3����������������Ϊa nm�������к���y��[(N5)6(H3O)3(NH4)4Cl]��Ԫ���õ�Ԫ���������ΪM����y�ļ������ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ī������������������Һ�ⶨ±���Ӻ����ij����ζ���������ˮFeCl3���ȱ���Ϸ�����Ӧ:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1���������ɵ�HC1��ˮ���գ�����Ī���������ˮFeCl3��ת������ͬʱ�õ����õĻ�ԭ��FeCl2��������ͼװ������������ƿ�з���162.5g��ˮFeCl3��225g�ȱ������Ʒ�Ӧ�¶���130���¼���3h����ȴ�����ˡ�ϴ�ӡ�����õ��ֲ�Ʒ���й�����������
2FeCl3+C6H4C12+HC1���������ɵ�HC1��ˮ���գ�����Ī���������ˮFeCl3��ת������ͬʱ�õ����õĻ�ԭ��FeCl2��������ͼװ������������ƿ�з���162.5g��ˮFeCl3��225g�ȱ������Ʒ�Ӧ�¶���130���¼���3h����ȴ�����ˡ�ϴ�ӡ�����õ��ֲ�Ʒ���й�����������
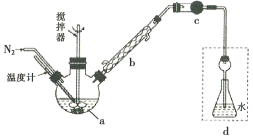
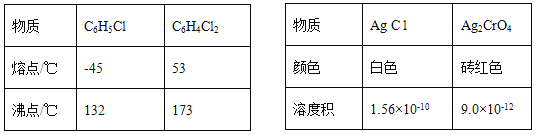
�ش���������:
(1)����a��������________����������������_______��
(2)��Ӧ����������Ҫ����ͨ��N2��Ŀ����__________������cʢװ���Լ���________(�����)��
A.��ʯ�� B.Ũ���� C.��ˮ�Ȼ��� D.�轺
(3)��δ���Һ�л��չ������ȱ���_____________
(4)���и�װ��(ʢ������ˮ)�ܴ���ͼ�����߿��ڲ��ֵ���_________(�����)��
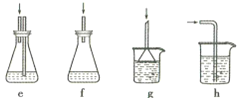
(5)����ƿ�ڵ���Һϡ����1000mL������ȡ10. 00mL����0. 2000mol��L-1AgNO3��Һ���еζ�����K2CrO4��Һ��ָʾ�����յ�����Ϊ______��������22.50mL AgNO3��Һ������ˮFeCl3��ת����Ϊ_____��
(6)�����ζ����ʱ�����ζ��ܼ��촦�������ݻᵼ�²ⶨ���ƫ_______(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. pH=7����Һһ��������
B. pH=6����Һһ��������
C. c(H+)��c(OH-)����Һһ���Լ���
D. c(OH-)=1��10-6mol/L����Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��������ͼװ�ý�������ˮ������Ӧ��ʵ�飬�������������ʣ���ش��������⣺
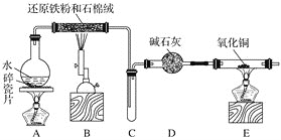
(1)Aװ�õ�������____________����ƿ�ײ������Ƭ��������_________________________��
(2)װ��B�з�����Ӧ�Ļ�ѧ����ʽ��____________________________________���÷�Ӧ����������__________������������__________________��
(3)D��������__________________________________��
(4)E�е�ʵ��������____________________________��
(5)A��B����װ����Ӧ�ȵ�ȼ________________���ľƾ�(��)�ƣ���ȼE���ƾ���֮ǰӦ���еIJ�����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��

��1������������������ȷ˳���ǣ�E�� �� �� �� �� �� ��F��____________
��2�����巢��װ���н��еķ�Ӧ��ѧ����ʽ��_________________����0.5mol MnO2���뷴Ӧʱ����������HCl������Ϊ____________�����ɵ�Cl2�ڱ�״���µ����ԼΪ____________��
��3����װ���У��ٱ���ʳ��ˮ��������______________����Ũ�����������__________��
��4����ѧʵ���м����Ƿ���Cl2��������ʪ��ĵ��۩�KI��ֽ�������Cl2�������ɹ۲쵽��������__________________��д����Ӧ����ʽ__________________��
��5��д��β������װ���н��еķ�Ӧ�Ļ�ѧ����ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������21.6 g��CO��CO2��ɵĻ�����壬�ڱ�״���������Ϊ13.44 L���ش��������⣺
(1)�û�������ƽ��Ħ������Ϊ________��
(2)���������̼ԭ�ӵ�����Ϊ________��

(3)�������������ͨ����ͼ��ʾװ�ã�����ռ���������(ʵ���ڱ�״���²ⶨ)��
���������ռ����������Ħ������Ϊ________��
����������Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��Q��T����Ԫ����Xԭ�ӵ�M��p�����2��δ�ɶԵ�����Yԭ�ӵ���Χ���ӹ���Ϊ3d64s2��Zԭ�ӵ�L���Ӳ��p�ܼ�����һ�չ����Qԭ�ӵ�L���Ӳ��p�ܼ���ֻ��1�ԳɶԵ�����Tԭ�ӵ�M���Ӳ���p������������д����
��1��X��Ԫ�ط���__________��Y��Ԫ�ط���__________��
��2��Z�ĵ����Ų�ʽ__________��Q�ĵ����Ų�ͼ__________��T�ĵ����Ų�ͼ__________��
��3��Y�ĵ�����Q�ĵ�����ȼ�յĻ�ѧ����ʽ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A. ����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B. �ڳ��³�ѹ�£�11.2L Cl2���еķ�����Ϊ0.5NA
C. 25�棬1.01��105Pa��64gSO2�к��е�ԭ����Ϊ3NA
D. ��״���£�11.2LH2O���еķ�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com