
【题目】下列物质中只含有共价键的是 ( )
A. NaCl、HCl、H2O、NaOHB. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2D. Na2O2、H2O2、H2O、O3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨气电子式:_______,其分子空间构型是_______,氨气溶于水,溶液呈____性,原因是______(用化学方程式解释)。用玻璃棒蘸浓盐酸接触氨气时,观察到的现象为_____,发生的反应是(用化学方程式表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净干燥的氯气通过如下装置与铁反应。(已知:氯气与铁的产物具有很强的吸湿性,应避免接触潮湿空气。)
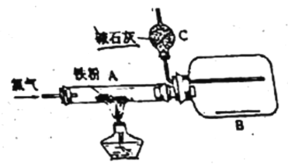
(1)当纯净干燥的氯气通过灼热铁粉时,可以看到装置A内产生_______,A中发生反应的化学方程式为:_______________。
(2)产物用氯气赶入装置B中冷却收集,推测装置C的作用是_______。
a.吸收多余的氯气 b.吸收空气中的水蒸气
c.吸收空气中的二氧化碳 d.吸收生成的氯化氢
(3)实验前需要用氯气排出装置内原有的空气,请给出一种简易判断装置内已充满氯气的方法__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素在生物体内的含量分布情况,下列表述不正确的是( )

A.I在非生物界中都能找到,体现了生物界与非生物界的统一性
B.Ⅱ含量虽少,但却是生物体正常生命活动不可缺少的
C.Ⅱ和Ⅲ称为必需元素,一旦缺乏就可能会导致相应的病症
D.P、S、K 、B、Ca、属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
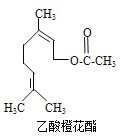
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③ B. ①②⑤ C. ①②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

①中试剂 | ①中现象 | 解释 | |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | 酸性Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成BaSO3沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com