
【题目】用纯净干燥的氯气通过如下装置与铁反应。(已知:氯气与铁的产物具有很强的吸湿性,应避免接触潮湿空气。)
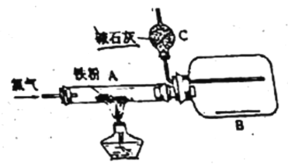
(1)当纯净干燥的氯气通过灼热铁粉时,可以看到装置A内产生_______,A中发生反应的化学方程式为:_______________。
(2)产物用氯气赶入装置B中冷却收集,推测装置C的作用是_______。
a.吸收多余的氯气 b.吸收空气中的水蒸气
c.吸收空气中的二氧化碳 d.吸收生成的氯化氢
(3)实验前需要用氯气排出装置内原有的空气,请给出一种简易判断装置内已充满氯气的方法__________________________。
【答案】棕褐色烟 2Fe+3Cl2 ![]() 2FeCl3 ad 装置B中充满黄绿色气体
2FeCl3 ad 装置B中充满黄绿色气体
【解析】
因灼热铁粉能与空气中氧气反应,所以实验前需要用氯气排出装置内原有的空气,防止干扰实验,当装置B中充满黄绿色气体时,点燃装置A初酒精灯,氯气与灼热铁粉反应生成氯化铁,反应生成的氯化铁氯气赶入装置B中冷却收集,装置C的作用是吸收过量氯气,防止污染环境,并吸收空气中的水蒸气进入装置B中,防止装置B中收集得到的具有很强的吸湿性的氯化铁接触潮湿空气。
(1)纯净干燥的氯气通过灼热铁粉时,Fe与氯气反应生成棕褐色烟,反应的化学方程式为2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
(2)产物用氯气赶入装置B中冷却收集,装置C的作用是吸收过量氯气,防止污染环境,并吸收空气中的水蒸气进入装置B中,防止装置B中收集得到的具有很强的吸湿性的氯化铁接触潮湿空气,故选ad;
(3)因灼热铁粉能与空气中氧气反应,所以实验前需要用氯气排出装置内原有的空气,防止干扰实验,当装置B中充满黄绿色气体时,说明装置内已充满氯气。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有①铁片 ②CaCO3 ③NH3·H2O ④NH4Cl ⑤酒精 ⑥H2S
其中属于电解质的是(填写序号)___,属于非电解质的是___,属于强电解质的是___,属于弱电解质的是___。
写出③和④的电离方程式:___,___。
写出其中可发生水解的物质的水解离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是核电荷数均小于20的元素,其结构或性质信息如表:
元素 | A | B | C | D | E |
性质或结构信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
请根据表中的信息回答下列问题:
(1)D离子的结构示意图:___,B原子的电子式:___,E离子的电子式:___。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:_________。
(3)A元素与E元素组成的化合物的电离方程式:____。
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是___;写出钾离子的电子式:____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴是小组对一种度旧合金(含有Cu、Fe、Si等元素)进行分离、回收利用,所设计工艺流程如下。
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13,当离子浓度小于1×10-5认为离子沉淀完全。

回答下列问题:
(1)操作I、lI、III为_______,固体A是__________(填化学式)。
(2)加入过量FeC13溶液过程中与较不活泼的金属反应的化学方程式_______。
(3)调节pH至2.9--3.2的目的___________________。
(4)①向溶液b中加入酸性KMn04溶液发生反应的离子方程式为_________________。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用amol/LKMnO4溶液滴定,恰好反应时消耗KMn04溶液VmL,则流程图中所得红棕色固体C的质量为___g(用含a、v的代数式表示)
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为____________(填金属阳离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO![]() 和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________。
和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________________。
(3)液氨的电离类似于水,试写出液氨的电离方程式________________________________ ;在液氨中加入NH4Cl,平衡将向________移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应,M(g)+N(g) ![]() R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应
R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应

A. 正反应是吸热反应,L是气体
B. 正反应是放热反应,L是气体
C. 正反应是吸热反应,L是固体
D. 正反应是放热反应,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中只含有共价键的是 ( )
A. NaCl、HCl、H2O、NaOHB. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2D. Na2O2、H2O2、H2O、O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A和B中都充人2molX和2molY,起始VA=0.8a L,VB=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
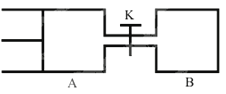
A. 两容器中达到平衡的时间A<B
B. 打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大
C. A容器中X的转化率为25%,且比B容器中的X的转化率小
D. 打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com