
【题目】A~E是核电荷数均小于20的元素,其结构或性质信息如表:
元素 | A | B | C | D | E |
性质或结构信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
请根据表中的信息回答下列问题:
(1)D离子的结构示意图:___,B原子的电子式:___,E离子的电子式:___。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:_________。
(3)A元素与E元素组成的化合物的电离方程式:____。
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是___;写出钾离子的电子式:____。

【答案】![]()
![]()
![]() CH4、H2O、HF(任写两个) HCl=H++Cl- 钾元素的相对原子质量 K+
CH4、H2O、HF(任写两个) HCl=H++Cl- 钾元素的相对原子质量 K+
【解析】
A原子核内只有1个质子,则A为H元素;B元素单质在空气中体积含量最多,则B为N元素;C是地壳中含量最多的金属元素,则C为Al;D元素单质和化合物的焰色反应均为黄色,则D为Na;E的单质在常温、常压下是黄绿色气体,则E为Cl。
(1)D为Na,对应的离子核外有2个电子层,最外层电子数为8,离子的结构示意图为![]() ,B为N,原子的电子式为
,B为N,原子的电子式为![]() ,E为Cl,离子的电子式为
,E为Cl,离子的电子式为![]() ;
;
(2)N元素的氢化物为NH3,含有10个电子,所含电子数相同的分子有多种,可为CH4、H2O、HF等;
(3)A元素与E元素组成的化合物为HCl,为强电解质,电离方程式为HCl=H++Cl-;
(4)数据“39.10”表示钾元素的相对原子质量,钾离子的电子式为 K+。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】一密闭容器中充入NO2在一定条件下进行反应 2NO2(g) ![]() 2NO(g)+O2(g),该反应达到平衡状态的标志是( )
2NO(g)+O2(g),该反应达到平衡状态的标志是( )
A. NO2的生成速率等于NO的消耗速率
B. NO2和O2的浓度之比等于2:1
C. 容器内压强不再随时间变化而变化
D. v(NO):V(O2)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气电子式:_______,其分子空间构型是_______,氨气溶于水,溶液呈____性,原因是______(用化学方程式解释)。用玻璃棒蘸浓盐酸接触氨气时,观察到的现象为_____,发生的反应是(用化学方程式表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如图:

(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是__,__。
(2)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,该钡试剂可以是__。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)电解过程中所发生反应的化学方程式为___,与电源正极相连的电极附近产生的气体是__,检验该气体可使用___试纸,现象是试纸变为___色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将潮湿的![]() 通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是
通过甲装置后再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂不可能是

A.饱和食盐水B.浓硫酸C.KI溶液D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上除去SO2尾气有多种方法.
I:烟道气中除去SO2的方法:2CO(g) + SO2(g) 2CO2(g)+ S(l)+Q (Q>0)
(1)该反应的平衡常数表达式为________。若保持其他条件不变,缩小反应容器的体积,平衡常数将会________ (选填“变大”、 “变小”或“不变”) 。
(2)下图是平衡时SO2的质量在不同温度下随压强的变化曲 线,判断: T1________T2 (选填“>”、“<”或“=”)。

(3)若在2L的密闭容器中进行上述反应,经测定在5 min内气体的质量减小了1.6g。则0~5 min的平均反应速率v(CO2)= _________________________________ 。
II:硫酸工业中用氢氧化钠溶液吸收SO2:2NaOH + SO2 → Na2SO3 + H2O, Na2SO3 + SO2 + H2O → 2NaHSO3已知: Na2SO3溶液显碱性,NaHSO3溶液显酸性,两者均易被氧化。
(1)用离子方程式解释Na2SO3溶液显碱性的原因。________________________
(2)若测得某次吸收SO2后的溶液的pH=7 (常温),则该溶液中c(H+)________ c(OH-) (选填“>”、“<”或“=”,下同),c(Na+)________ c(SO3 2-)+c(HSO3-)。上述溶液在空气中放置一段时间后,溶液的pH________7;原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净干燥的氯气通过如下装置与铁反应。(已知:氯气与铁的产物具有很强的吸湿性,应避免接触潮湿空气。)
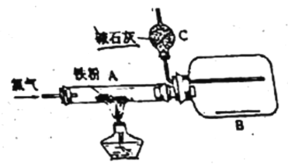
(1)当纯净干燥的氯气通过灼热铁粉时,可以看到装置A内产生_______,A中发生反应的化学方程式为:_______________。
(2)产物用氯气赶入装置B中冷却收集,推测装置C的作用是_______。
a.吸收多余的氯气 b.吸收空气中的水蒸气
c.吸收空气中的二氧化碳 d.吸收生成的氯化氢
(3)实验前需要用氯气排出装置内原有的空气,请给出一种简易判断装置内已充满氯气的方法__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com