
【题目】单质钛(Ti)抗腐蚀能力强(放在大海中几周后仍金光闪闪),机械强度高,有“未来金属”之称。又因用它制的“骨头”置入人体后可以在上面长肉,所以又有“亲生物金属”之美誉。工业上常用硫酸分解钛铁矿(FeTiO3,铁为+2价)的方法来制取TiO2,再由TiO2制金属钛。主要反应有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
上述反应中,属于氧化还原反应的有( )
A.①②
B.①⑤
C.③④
D.④⑤
【答案】D
【解析】
有元素化合价变化的反应是氧化还原反应。
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O反应中,元素化合价都没变,属于非氧化还原反应;
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4反应中,元素化合价都没变,属于非氧化还原反应;
③H2TiO3![]() TiO2+H2O反应中,元素化合价都没变,属于非氧化还原反应;
TiO2+H2O反应中,元素化合价都没变,属于非氧化还原反应;
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑反应中,碳元素化合价升高、氯元素化合价降低,有元素化合价变化,属于氧化还原反应;
TiCl4↑+2CO↑反应中,碳元素化合价升高、氯元素化合价降低,有元素化合价变化,属于氧化还原反应;
⑤TiCl4+2Mg![]() 2MgCl2+Ti反应中,镁元素化合价升高、钛元素化合价降低,有元素化合价变化,属于氧化还原反应;
2MgCl2+Ti反应中,镁元素化合价升高、钛元素化合价降低,有元素化合价变化,属于氧化还原反应;
综上所述,④⑤属于氧化还原反应,故选D。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过![]() 和
和![]() 化合来制备甲醇。已知某些化学键的键能数据如下表:
化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 |
|
|
|
|
|
键能 | 413 | 436 | 358 | 1072 | 463 |
已知![]() 中的
中的![]() 与
与![]() 之间为三键,则工业制备甲醇的热化学方程式为________。
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为![]() 的密闭容器内充入
的密闭容器内充入![]() 和
和![]() ,加入合适催化剂(体积可以忽略不计),在
,加入合适催化剂(体积可以忽略不计),在![]() 时开始反应,并用压力计监测容器内压强的变化如下表:
时开始反应,并用压力计监测容器内压强的变化如下表:
反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到![]() 时,以
时,以![]() 表示的平均反应速率
表示的平均反应速率![]() ________,该温度下平衡常数
________,该温度下平衡常数![]() ________
________![]() ,若升高温度,则
,若升高温度,则![]() 值________(填“增大”“减小”或“不变")。
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比![]() 分别为
分别为![]() 、
、![]() 、
、![]() 、
、![]() 下,反应温度对
下,反应温度对![]() 平衡转化率影响的曲线。
平衡转化率影响的曲线。

①曲线![]() 对应的投料比为________。
对应的投料比为________。
②当曲线![]() 、
、![]() 、
、![]() 对应的投料比达到相同的
对应的投料比达到相同的![]() 平衡转化率时,对应的反应温度与投料比的关系是________。
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为![]() 、反应温度为
、反应温度为![]() 时,平衡混合气中
时,平衡混合气中![]() 的物质的量分数是________(精确到
的物质的量分数是________(精确到![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A. ①②③B. ①③⑤C. ②④⑤D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将70g过氧化钠和氧化钠混合物与98g水充分反应,所得溶液恰好能被含硫酸98g的酸溶液中和,求:
(1)原混合物中过氧化钠和氧化钠的质量分别是多少?___
(2)所得氢氧化钠溶液的质量分数是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
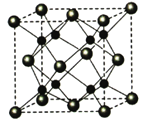
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO 。
。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上经常用硫酸亚铁糖衣片给这种贫血病人补铁。现取20粒糖衣片,质量为10g,溶于40g水中,向所配溶液中滴加氢氧化钠溶液至略过量过滤、洗涤、干燥,然后进行灼烧到固体质量不再发生改变,质量为0.8g。试计算:
(1)该糖衣片中硫酸亚铁的质量分数______。
(2)1粒糖衣片中含铁元素的质量______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
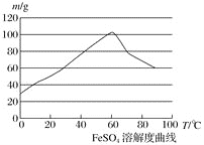
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是
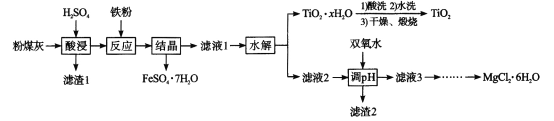
A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2![]() xH2O产率降低
xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2![]() 6H2O需要在HCl的气氛下蒸发浓缩
6H2O需要在HCl的气氛下蒸发浓缩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com