
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g).
(1)每消耗8gCH4转移mol电子.
(2)已知:①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1
③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1
④CH4(g)+2H2O(g)CO(g)+3H2(g)△H4
由此计算△H4=kJmol﹣1 .
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g) 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1
①0~tmin内,该反应的平衡反应速率v(H2)= .
②T℃时,该反应的平衡常数K= .
③当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , 则该反应是反应(填“吸热”或“放热”).
(4)一种熔融碳酸盐燃料电池的工作原理示意图如图: ①该放电过程中K+和Na+向电极(填“A”或“B”)移动.
②该电池的负极反应式为 . 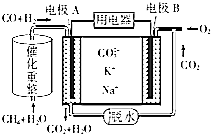
【答案】
(1)3
(2)c+3b﹣2a
(3)![]() mol/(L?min);6.75;吸热
mol/(L?min);6.75;吸热
(4)B;3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2
【解析】解:(1)8gCH4的物质的量为n= ![]() =
= ![]() =0.5mol,CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g),反应中C元素化合价由﹣4价升高为+2价,化合价总共升高6价,该反应中转移6e﹣ , 则0.5molCH4反应转移3mol电子,所以答案是:3;(2)①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1根据盖斯定律可知:③+②×3﹣①×2,得到④CH4(g)+2H2O(g)CO(g)+3H2(g)所以△H4=(c+3b﹣2a)kJmol﹣1 , 所以答案是:c+3b﹣2a;(3)①向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g),反应开始c(CH4)=1molL﹣1 , 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1 , v(CH4)=
=0.5mol,CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g),反应中C元素化合价由﹣4价升高为+2价,化合价总共升高6价,该反应中转移6e﹣ , 则0.5molCH4反应转移3mol电子,所以答案是:3;(2)①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1根据盖斯定律可知:③+②×3﹣①×2,得到④CH4(g)+2H2O(g)CO(g)+3H2(g)所以△H4=(c+3b﹣2a)kJmol﹣1 , 所以答案是:c+3b﹣2a;(3)①向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g),反应开始c(CH4)=1molL﹣1 , 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1 , v(CH4)= ![]() =
= ![]() mol/(Lmin),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3×
mol/(Lmin),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3× ![]() mol/(Lmin)=
mol/(Lmin)= ![]() mol/(Lmin), 所以答案是:
mol/(Lmin), 所以答案是: ![]() mol/(Lmin);
mol/(Lmin);
②T℃时,1L恒容密闭容器中
CH4(g)+ | H2O | CO(g)+ | 3H2(g) | |
起始量(mol): | 1 | 1 | 0 | 0 |
变化量(mol): | 0.5 | 0.5 | 0.5 | 1.5 |
平衡量(mol): | 0.5 | 0.5 | 0.5 | 1.5 |
平衡常数K= ![]() =
=  =
= ![]() =6.75,
=6.75,
所以答案是:6.75;③升高温度平衡向吸热的方向移动,T℃时,容器中c(CO)=0.5molL﹣1 , 当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , CO浓度增多,平衡向正反应方向移动,所以正反应为吸热反应,所以答案是:吸热;(4)①原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,电池工作时,阳离子向正极移动,B为正极,即K+和Na+向电极B移动,所以答案是:B;②甲烷和水蒸气反应CH4+2H2OCO+3H2 , 原电池工作时,A为负极,负极上CO和H2失电子发生了氧化反应,CO和H2被氧化生成二氧化碳和水,电极反应为:3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2 , B为正极,正极为氧气得电子生成CO32﹣ , 反应为2O2+4CO2+8e﹣=4CO32﹣ , 所以答案是:3H2+CO+4CO32﹣﹣8e﹣=3H2O+5CO2 .
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】下列物质里含氢原子数最多的是 ( )
A. 1 mol H2 B. 0.5molNH3
C. 6.02×1023个的CH4分子 D. 0.3molH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,则下列说法正确的是( )
A.2.4g Mg变成Mg2+时失去的电子数为0.1 NA
B.标准状况下,11.2 L水所含的原子数为1.5 NA
C.在常温常压下,32g氧气所含原子数目为2NA
D.0.1mol/LK2SO4溶液含有 K+0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值.下列叙述正确的是( )
A.标准状况下,2.24L戊烷中存在的共价键总数为1.6NA
B.23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA
C.过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA
D.1L0.1molL﹣1的NaH2PO4溶液中H2PO4﹣、HPO42﹣和PO43﹣离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚醛树脂是应用广泛的高分子材料,可用酚类与醛类在酸或碱的催化下相互缩合而成,类似的合成过程如: 反应① 
反应② 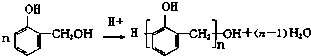
(1)化合物Ⅰ的分子式 .
(2)苯酚与浓溴水反应的化学方程式为 .
(3)化合物Ⅱ  也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为; 有机物Ⅲ发生类似反应②的反应,生成高分子化合物Ⅳ的结构简式为 .
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为; 有机物Ⅲ发生类似反应②的反应,生成高分子化合物Ⅳ的结构简式为 .
(4)有关化合物Ⅱ和Ⅲ的说法正确的有(填字母)
A.都属于芳香烃
B.都能与FeCl3溶液发生显色反应
C.都能与NaHCO3溶液反应放出CO2
D.1mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业.碳化法生产碳酸钡的工艺流程示意图如下: 
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2 .
回答下列问题:
(1)煅烧时发生反应的化学方程式为 , 该反应的氧化产物的电子式为;当温度过高时,尾气中有毒气体的含量会升高,原因是(用化学方程式表示).
(2)为了提高浸取速率,可采取的措施是(任写一种).
(3)碳化时发生反应的离子方程式为 .
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32﹣+BaS2O3=BaCO3+S2O32﹣ , 该反应的平衡常数为【已知Ksp(BaCO3)=2.5×10﹣9 , Ksp(BaS2O3)=1.6×10﹣5】.
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为 , 用等式表示溶液中所有离子之间的关系: .
(6)BaCO3不能用于医疗用的“钡餐”,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是一种黄绿色粉末,可用于制造特殊陶瓷材料、催化剂等,可由金属镁和纯净的氮气反应制得,某化学兴趣小组同学利用如图所示装置来制备少量的Mg3N2 . 
已知Mg3N2易与水反应,有关反应方程式为Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
回答下列问题:
(1)装置A中反应容器的名称为 .
(2)装置B中的试剂为 , 装置F的作用是 .
(3)装置C、E均需要加热,应先加热 , 理由是 .
(4)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为 .
(5)若C中NH3的转化率不高,易产生的问题是 , 解决方法是 .
(6)若实验结束后,将装置E中固体全部取出,称量为ag,向其中依次加入足量的稀盐酸和NaOH溶液,充分反应后过滤、洗涤、干燥,最后得沉淀bg,则产品中氮化镁的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com