
【题目】氮化镁(Mg3N2)是一种黄绿色粉末,可用于制造特殊陶瓷材料、催化剂等,可由金属镁和纯净的氮气反应制得,某化学兴趣小组同学利用如图所示装置来制备少量的Mg3N2 . 
已知Mg3N2易与水反应,有关反应方程式为Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑.
回答下列问题:
(1)装置A中反应容器的名称为 .
(2)装置B中的试剂为 , 装置F的作用是 .
(3)装置C、E均需要加热,应先加热 , 理由是 .
(4)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为 .
(5)若C中NH3的转化率不高,易产生的问题是 , 解决方法是 .
(6)若实验结束后,将装置E中固体全部取出,称量为ag,向其中依次加入足量的稀盐酸和NaOH溶液,充分反应后过滤、洗涤、干燥,最后得沉淀bg,则产品中氮化镁的质量分数为 .
【答案】
(1)锥形瓶
(2)碱石灰;防止空气中水蒸气进入硬质玻璃管E中
(3)C;使C中产生的氮气排出E中的空气
(4)2NH3+3CuO ![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
(5)D中发生倒吸现象;在C、D之间加上一个缓冲瓶
(6)![]()
【解析】解:(1)由装置A中反应容器为锥形瓶,所以答案是:锥形瓶;(2)A装置制备氨气,B中碱石灰干燥氨气,C中氨气与CuO反应生成制备氮气,D中浓硫酸干燥氮气,E装置中氮气与Mg反应生成氮化镁,加热条件下装置中氧气与Mg反应生成MgO,应下用氮气排尽装置内空气后再制备氮化镁,F防止空气中水蒸气进入硬质玻璃管E,避免氮化镁发生水解,所以答案是:碱石灰;防止空气中水蒸气进入硬质玻璃管E中;(3)装置C、E均需要加热,应先加热C后加热E,理由是:使C中产生的氮气排出E中的空气,防止生成氧化镁, 所以答案是:C;使C中产生的氮气排出E中的空气;(4)装置C中的现象是黑色的氧化铜逐渐变红,说明生成Cu,氨气被氧化生成氮气,还还生成水,反应方程式为:2NH3+3CuO ![]() 3Cu+N2↑+3H2O,所以答案是:2NH3+3CuO
3Cu+N2↑+3H2O,所以答案是:2NH3+3CuO ![]() 3Cu+N2↑+3H2O;(5)若C中NH3的转化率不高,D中浓硫酸会吸收氨气,容易发生倒吸,解决方法是:在C、D之间加上一个缓冲瓶,所以答案是:D中发生倒吸现象;在C、D之间加上一个缓冲瓶.(6)最终达到沉淀bg为氢氧化镁的质量,根据Mg元素守恒,产品中Mg元素质量为bg×
3Cu+N2↑+3H2O;(5)若C中NH3的转化率不高,D中浓硫酸会吸收氨气,容易发生倒吸,解决方法是:在C、D之间加上一个缓冲瓶,所以答案是:D中发生倒吸现象;在C、D之间加上一个缓冲瓶.(6)最终达到沉淀bg为氢氧化镁的质量,根据Mg元素守恒,产品中Mg元素质量为bg× ![]() ,则产品中N元素质量为(a﹣
,则产品中N元素质量为(a﹣ ![]() b)g,根据N原子守恒,氮化镁的质量分数为[
b)g,根据N原子守恒,氮化镁的质量分数为[ ![]() ×
× ![]() ×100g/mol]÷ag=
×100g/mol]÷ag= ![]() ,所以答案是:
,所以答案是: ![]() .
.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况).(已知MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: 
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下: 2Cu2++4I﹣=2CuI(白色)↓+I2 2S2O32﹣+I2=2I﹣+S4O62﹣
①滴定选用的指示剂为 , 滴定终点观察到的现象为;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点.再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 , (结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀.已知KSP[Cu (OH)2]=2.0×10﹣20(mol/L)3 , 计算沉淀生成后溶液中c(Cu2+)=mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0molL﹣1计算).
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 1.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0molL﹣1HNO3、1.0molL﹣1NaOH.由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2 , 使其充分反应;
②;③过滤;
④;⑤过滤、洗涤、干燥;⑥900℃煅烧.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)CO(g)+3H2(g).
(1)每消耗8gCH4转移mol电子.
(2)已知:①2CO(g)+O2(g)2CO2(g)△H1=akJmol﹣1②CO(g)+H2O(g)CO2(g)+H2(g)△H2=bkJmol﹣1
③CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=ckJmol﹣1
④CH4(g)+2H2O(g)CO(g)+3H2(g)△H4
由此计算△H4=kJmol﹣1 .
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2OCO(g)+3H2(g) 经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5molL﹣1
①0~tmin内,该反应的平衡反应速率v(H2)= .
②T℃时,该反应的平衡常数K= .
③当温度升高到(T+100)℃时,容器中c(CO)=0.75molL﹣1 , 则该反应是反应(填“吸热”或“放热”).
(4)一种熔融碳酸盐燃料电池的工作原理示意图如图: ①该放电过程中K+和Na+向电极(填“A”或“B”)移动.
②该电池的负极反应式为 . 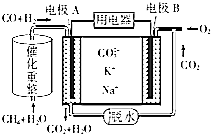
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1 . Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
(1)W位于元素周期表第周期族,其基态原子的核外电子排布式为 .
(2)Y的气态氢化物的稳定性比Z的气态氢化物的稳定性(填“强”或“弱”).Y的第一电离能比Z的(填“大”或“小”).
(3)X的最常见的气态氢化物分子的VSEPR模型为 , 分子的空间构型是 .
(4)原子总数相同、价电子总数相同的分子或离子成为等电子体.分别写出一种与X02﹣互为等电子体的单质和化合物的化学式:、 . XO2﹣的中心原子采用杂化.
(5)[W(CN)6]3﹣离子中W的阳离子与CN﹣之间的共价键称为 , 该化学键能够形成的原因是 .
(6)图是R晶体的晶胞结构示意图,每个晶胞中含有个R原子. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有原子序数小于20的A,B,C,D,E,F 6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B,D两元素原子核内质子数之和的 ![]() ;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
(1)用电子式表示A和E形成化合物的过程 .
(2)写出F原子的核外电子排布式 .
(3)写出A2D的电子式 , 其分子中(填“含”或“不含”)σ键,(填“含”或“不含”)π键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用25 g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:CH3CH2OH ![]() CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如右图所示,有关数据如表:
CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如右图所示,有关数据如表: 
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
回答下列问题:
(1)在装置c中应加入(选填序号),其目的是吸收反应中可能生成的酸性气体. ①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的 层.(填“上”或“下”)
(3)判断d管中制备二溴乙烷反应已结束的最简单方法是 .
(4)若产物中有少量未反应的Br2 , 最好用(填正确选项前的序号)洗涤除去. ①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)以1,2﹣二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2﹣二溴乙烷通过(①)反应制得(②),②通过(③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯. ①(填反应类型),其化学方程式 .
②(填反应类型).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com