
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷Ͼɵ�ص�ͭñ��Cu��Zn �ܺ���ԼΪ99%������Cu���Ʊ�ZnO �IJ���ʵ��������£� 
��1��д��ͭñ�ܽ�ʱͭ������ϡ���ᡢ30%H2O2��Ӧ�����ӷ�Ӧ����ʽ����ͭñ�ܽ���ȫ������ȣ����У�����Һ�й�����H2O2��ȥ��
��2��Ϊȷ������п�ң���Ҫ�ɷ�ΪZn��ZnO������Ϊ�����������������ʵ������ⶨ��ȥH2O2 ����Һ��Cu2+�ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����Na2S2O3����Һ�ζ����յ㣮���������з�Ӧ�����ӷ���ʽ���£� 2Cu2++4I��=2CuI����ɫ����+I2 2S2O32��+I2=2I��+S4O62��
�ٵζ�ѡ�õ�ָʾ��Ϊ �� �ζ��յ�۲쵽������Ϊ��
��ijͬѧ��ȡ1.0g���ͭñ����ʵ�飬�õ�100.00mL����Cu2+����Һ����ȡ20.00mL��������Cu2+����Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�������ҺpH=3��4�����������KI����0.1000mol/L Na2S2O3����Һ�ζ����յ㣮���ظ�����ʵ��3�Σ���¼�������£�
ʵ���� | 1 | 2 | 3 | 4 |
V��Na2S2O3����mL�� | 28.32 | 25.31 | 25.30 | 25.32 |
������ͭñ��Cu����������Ϊ �� �����������λ��Ч���֣����ζ�ǰ��Һ�е�H2O2û�г����������ⶨc ��Cu2+���������ƫ�ߡ�����ƫ�͡�����Ӱ�족����
��3�������£�����50mL 0.0001mol/L CuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ�������˳�������֪KSP[Cu ��OH��2]=2.0��10��20��mol/L��3 �� ����������ɺ���Һ��c��Cu2+��=mol/L��
��4����֪pH��11 ʱZn��OH��2 ������NaOH��Һ����[Zn��OH��4]2�� �� �±��г��˼������������������������pH����ʼ������pH ����������Ũ��Ϊ1.0molL��1���㣩��
��ʼ������pH | ������ȫ��pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 1.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
ʵ���п�ѡ�õ��Լ���30%H2O2��1.0molL��1HNO3��1.0molL��1NaOH���ɳ�ȥͭ����Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��������Һ�м�������30% H2O2 �� ʹ���ַ�Ӧ��
�����۹��ˣ�
�����ݹ��ˡ�ϴ�ӡ������900�����գ�
���𰸡�
��1��Cu+H2O2+2H+=Cu2++2H2O
��2��������Һ����ɫ��ȥ��80.99%��ƫ��
��3��2��10��10
��4���μ�1.0mol?L��1NaOH��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ������Һ�еμ�1.0mol?L��1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ
���������⣺��1����Ϊ˫��ˮ��������Һ���Ȱ�ͭ����������ͭ����Ȼ����һ�����ķ�Ӧ���γ�һ��ƽ�⣬�����γɵ�����ͭ���Ͼͻᱻϡ�����ܽ⣬ƽ�ⱻ���ƣ���Ӧ����������У��ʶ����ܽ⣬��Ӧ�����ӷ���ʽΪ��Cu+H2O2+2H+=Cu2++2H2O�����Դ��ǣ�Cu+H2O2+2H+=Cu2++2H2O����2���ٵ�����ҺΪָʾ���������һ��Na2S2O3��Һ����ʱ����Һ��ɫ��ȥ���������ɫ���䣬˵���ζ������յ㣬���Դ��ǣ�������Һ����ɫ��ȥ���ڸ����������ݿ�֪����һ������ƫ��ϴ�ΪżȻ��Ӧȥ��������Na2S2O3����Һ�����Ϊ ![]() mL=25.31mL�������ĵ�Na2S2O3�����ʵ���Ϊ0.1000mol/L��0.02531L=0.002531mol�����ݷ�Ӧ2Cu2++4I���T2CuI����ɫ����+I2��2S2O32��+I2�T2I��+S4O62���ù�ϵʽ2Cu2+��I2��2S2O32�� �� ���ݹ�ϵ�����ͭԪ�ص�����Ϊ0.002531mol��
mL=25.31mL�������ĵ�Na2S2O3�����ʵ���Ϊ0.1000mol/L��0.02531L=0.002531mol�����ݷ�Ӧ2Cu2++4I���T2CuI����ɫ����+I2��2S2O32��+I2�T2I��+S4O62���ù�ϵʽ2Cu2+��I2��2S2O32�� �� ���ݹ�ϵ�����ͭԪ�ص�����Ϊ0.002531mol�� ![]() ��64g/mol=0.8099g������ͭ����������Ϊ
��64g/mol=0.8099g������ͭ����������Ϊ ![]() ��100%=80.99%�����ζ�ǰ��Һ�е�H2O2û�г��������������Ӻ�˫��ˮ���������Ӳ����ĵⵥ�ʣ��ᵼ��Na2S2O3����Һ����ƫ�������ⶨc ��Cu2+������ƫ�����Դ��ǣ�80.99%��ƫ��3�������£�����50mL 0.0001mol/L CuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ������������ͭ��������Һ��ʣ����������Ƶ����ʵ���Ũ��Ϊ
��100%=80.99%�����ζ�ǰ��Һ�е�H2O2û�г��������������Ӻ�˫��ˮ���������Ӳ����ĵⵥ�ʣ��ᵼ��Na2S2O3����Һ����ƫ�������ⶨc ��Cu2+������ƫ�����Դ��ǣ�80.99%��ƫ��3�������£�����50mL 0.0001mol/L CuSO4��Һ�м���50mL0.00022mol/LNaOH��Һ������������ͭ��������Һ��ʣ����������Ƶ����ʵ���Ũ��Ϊ ![]() =0.00001mol/L������c��Cu2+��=
=0.00001mol/L������c��Cu2+��= ![]() =
= ![]() mol/L=2��10��10mol/L�� ���Դ��ǣ�2��10��10����4���ɳ�ȥͭ����Һ�Ʊ�ZnO ��ʵ�鲽������Ϊ���٢�����Һ�м���30%H2O2 �� ʹ���ַ�Ӧ��Ŀ��ʹFe2+ת����ȫΪFe3+���ڵμ�NaOH��Һ��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ���۹��ˣ�������Һ�еμ�1.0molL��1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ���ݹ��ˡ�ϴ�ӡ������900�����գ��Ƶ�����п�����Դ��ǣ��μ�1.0molL��1NaOH��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ������Һ�еμ�1.0molL��1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ��
mol/L=2��10��10mol/L�� ���Դ��ǣ�2��10��10����4���ɳ�ȥͭ����Һ�Ʊ�ZnO ��ʵ�鲽������Ϊ���٢�����Һ�м���30%H2O2 �� ʹ���ַ�Ӧ��Ŀ��ʹFe2+ת����ȫΪFe3+���ڵμ�NaOH��Һ��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ���۹��ˣ�������Һ�еμ�1.0molL��1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ���ݹ��ˡ�ϴ�ӡ������900�����գ��Ƶ�����п�����Դ��ǣ��μ�1.0molL��1NaOH��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ������Һ�еμ�1.0molL��1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һ�����ʵ���Ũ�ȵ�Ũ��������480mL 3.68mol/L��ϡ���
��1��������18.4mol/L��Ũ����������Һ����Ҫ�õ�Ũ��������Ϊ ��
��2�����ƹ�������Ҫ���������е�������ţ���A��������ƽB���ձ�C.100������ͲD.50������ͲE����ƿF��������G����ͷ�ι�H���Թ�I����������ƿ
��3���뽫���и�����������ȷ��������ں����ϣ�
A.����Ͳ��ȡŨH2SO4
B.��Һ��ȴ������
C.�����ߵ�ҡ��
D.�ý�ͷ�ιܼ�����ˮ���̶���
E.ϴ����Ͳ
F.ϡ��ŨH2SO4
G.����Һת������ƿ
�������ȷ��˳������Ϊ�� �� ��
��4���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ������ķ�����
������ţ���
A.��������Һ�壬ʹ��Һ����̶�������
B.���������һ������Ũ����
C.С�ļ�������ƿ����������ʹ��Һ����̶�������
D.��������
��5����������������Ƶ�ϡ����Ũ���к�Ӱ�죿����ƫ��ƫС����Ӱ����д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ�������
B������ƿ������ϴ�Ӻ������������ˮ
C������ʱ����
��6��������Ͳ��ȡŨ���ᣬ��������С�ĵؼ�������ˮ��������ȣ�����ȴ�����º��ټ���ˮ���̶��ߣ��ٽ�����ȣ�����Ϊ�˷��Ƿ���ȷ��������ȷ��ָ�����д���֮�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڽ������ʶ�д������ �� ��
A. �ᴿ���岻�ܲ��ù��˵ķ���
B. ���ö����ЧӦ����������Һ�ͽ���
C. �������Һ�ȶ�
D. ��Һ�ǵ����Եģ������Ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤��������������˵����ȷ���ǣ�������
A.2.4g Mg���Mg2+ʱʧȥ�ĵ�����Ϊ0.1 NA
B.��״���£�11.2 Lˮ������ԭ����Ϊ1.5 NA
C.�ڳ��³�ѹ�£�32g��������ԭ����ĿΪ2NA
D.0.1mol/LK2SO4��Һ���� K+0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA���������ӵ�������ֵ������������ȷ���ǣ� ��
A.��״���£�2.24L�����д��ڵĹ��ۼ�����Ϊ1.6NA
B.23gNO2��N2O4�Ļ�������к��еĵ�ԭ����Ϊ0.5NA
C.���������������̼��Ӧʱ������0.1mol����ת�Ƶĵ�����Ϊ0.4NA
D.1L0.1molL��1��NaH2PO4��Һ��H2PO4����HPO42����PO43��������֮��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��֬��Ӧ�ù㷺�ĸ߷��Ӳ��ϣ����÷�����ȩ��������Ĵ�������϶��ɣ����Ƶĺϳɹ����磺 ��Ӧ�� 
��Ӧ�� 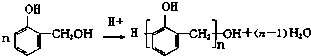
��1���������ķ���ʽ ��
��2��������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽΪ ��
��3���������  Ҳ����CH3CHO�������Ʒ�Ӧ�ٵķ�Ӧ�������л���÷�Ӧ��ѧ����ʽΪ�� �л���������Ʒ�Ӧ�ڵķ�Ӧ�����ɸ߷��ӻ�������Ľṹ��ʽΪ ��
Ҳ����CH3CHO�������Ʒ�Ӧ�ٵķ�Ӧ�������л���÷�Ӧ��ѧ����ʽΪ�� �л���������Ʒ�Ӧ�ڵķ�Ӧ�����ɸ߷��ӻ�������Ľṹ��ʽΪ ��
��4���йػ������͢��˵����ȷ����������ĸ��
A.�����ڷ�����
B.������FeCl3��Һ������ɫ��Ӧ
C.������NaHCO3��Һ��Ӧ�ų�CO2
D.1mol�Ģ�������2mol��NaOH��ȫ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��Mg3N2����һ�ֻ���ɫ��ĩ�����������������մɲ��ϡ������ȣ����ɽ���þ�ʹ����ĵ�����Ӧ�Ƶã�ij��ѧ��ȤС��ͬѧ������ͼ��ʾװ�����Ʊ�������Mg3N2 �� 
��֪Mg3N2����ˮ��Ӧ���йط�Ӧ����ʽΪMg3N2+6H2O�T3Mg��OH��2��+2NH3����
�ش��������⣺
��1��װ��A�з�Ӧ����������Ϊ ��
��2��װ��B�е��Լ�Ϊ �� װ��F�������� ��
��3��װ��C��E����Ҫ���ȣ�Ӧ�ȼ��� �� ������ ��
��4��װ��C�е������Ǻ�ɫ������ͭ��죬�йط�Ӧ�Ļ�ѧ����ʽΪ ��
��5����C��NH3��ת���ʲ��ߣ��ײ����������� �� ��������� ��
��6����ʵ�������װ��E�й���ȫ��ȡ��������Ϊag�����������μ���������ϡ�����NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�������ó���bg�����Ʒ�е���þ����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������SO2ͨ����Fe��NO3��3��Һ�У���Һ���ػ�ɫ��Ϊdz��ɫ���������ֱ�Ϊ�ػ�ɫ����������BaCl2��Һ��������ɫ������������һϵ�б仯�����У����ձ���ԭ��Ԫ���ǣ� ��
A.S
B.Fe
C.Cl
D.N
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com